
【題目】下表是某同學探究Na2SO3溶液和鉻(VI)鹽溶液反應規律的實驗記錄,已知:Cr2O72-(橙色)+ H2O![]() 2CrO42-(黃色)+ 2H+
2CrO42-(黃色)+ 2H+
序號 | a | b | 現象 | |
| 1 | 2 mL 0.05 mol·L1 K2Cr2O7溶液(pH = 2) | 3滴飽和Na2SO3溶液(pH = 9) | 溶液變綠色(含Cr3+) |
2 | 2 mL 0.1 mol·L1 K2CrO4溶液(pH = 8) | 3滴飽和Na2SO3溶液 | 溶液沒有明顯變化 | |
3 | 2 mL飽和Na2SO3溶液 | 3滴0.05 mol·L1 K2Cr2O7溶液 | 溶液變黃色 | |
4 | 2 mL蒸餾水 | 3滴0.05 mol·L1 K2Cr2O7溶液 | 溶液變成淺橙色 |
下列說法不正確的是
A. 實驗1中的綠色溶液中含有SO42-
B. 實驗1、2的a溶液中所含的離子種類相同
C. 向實驗3溶液中繼續滴加過量硫酸可使溶液變為淺橙色
D. 實驗4的目的是排除稀釋對溶液顏色變化造成的影響
【答案】C
【解析】
由4個實驗結果對比可知,K2Cr2O7與Na2SO3在酸性條件下發生氧化還原反應,在堿性條件下不發生氧化還原反應;由平衡Cr2O72-(橙色)+ H2O![]() 2CrO42-(黃色)+ 2H+可知,溶液的堿性增強,平衡正向移動,以此分析。
2CrO42-(黃色)+ 2H+可知,溶液的堿性增強,平衡正向移動,以此分析。
A. 實驗1中K2Cr2O7與Na2SO3發生了氧化還原反應,Na2SO3被氧化為Na2SO4,K2Cr2O7被還原為Cr3+,溶液呈綠色,故A正確;
B. 實驗1、2中的a溶液中都存在平衡:Cr2O72-(橙色)+ H2O![]() 2CrO42-(黃色)+ 2H+,故溶液中所含的離子種類相同,故B正確;
2CrO42-(黃色)+ 2H+,故溶液中所含的離子種類相同,故B正確;
C.Na2SO3溶液呈堿性,滴加3滴0.05 mol·L1 K2Cr2O7溶液,平衡Cr2O72-(橙色)+ H2O![]() 2CrO42-(黃色)+ 2H+向正向移動,溶液呈黃色;若向實驗3溶液中繼續滴加過量硫酸,則在酸性條件下,K2Cr2O7與Na2SO3發生氧化還原反應,溶液變綠色,故C錯誤;
2CrO42-(黃色)+ 2H+向正向移動,溶液呈黃色;若向實驗3溶液中繼續滴加過量硫酸,則在酸性條件下,K2Cr2O7與Na2SO3發生氧化還原反應,溶液變綠色,故C錯誤;
D. 實驗4和實驗3相比,b溶液相同,a為等體積的蒸餾水,溶液由黃色變成淺橙色,顏色反而加深,故可排除稀釋對溶液顏色變化造成的影響,故D正確。
故選C。


科目:高中化學 來源: 題型:
【題目】(1)有機物A中只含C、H、O三種元素,A的蒸氣密度是相同狀況下氫氣密度的83倍,分子中碳原子總數是氧原子總數的3倍,則A的分子式為________。
(2)芳香烴B的相對分子質量在100~110之間,1 mol B充分燃燒可生成72 g水,則B的分子式是________。
(3)某含C、H、O三種元素的有機物,經燃燒分析實驗測定其碳的質量分數是64.86%,氫的質量分數是13.51%,則其實驗式是________,通過質譜儀測定其相對分子質量為74,則其分子式為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銨明礬[NH4Al(SO4)2·12H2O]是分析化學常用的基準試劑,工業上常用鋁土礦(主要成分為Al2O3)來生產銨明礬,其中Z的水溶液可用于傷口消毒,其工藝流程圖如下:
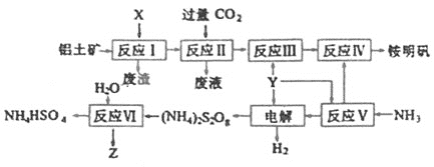
(1)寫出反應Ⅱ的離子方程式________。
(2)從反應IV的銨明礬溶液中獲得銨明礬晶體的實驗操作依次為________、________、過濾、洗滌(填操作名稱)。
(3)反應Ⅵ的化學方程式為________。
(4)廢水中含有Fe2+、Mn2+等金屬離子對自然環境有嚴重的破壞作用,可用(NH4)2S2O8氧化除去。寫出Mn2+被氧化生成MnO2的離子方程式為________。Z也有較強氧化性,在實際生產中不用Z氧化Mn2+的原因是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】生物質能是一種潔凈、可再生的能源。生物質氣(主要成分為CO、CO2、H2等)與H2混合,催化合成甲醇是生物質能利用的方法之一。
(1)上述反應的催化劑含有Cu、Zn、Al等元素。寫出基態Zn原子的核外電子排布式________。
(2)根據等電子原理,寫出CO分子的結構式______。
(3)甲醇催化氧化可得到甲醛,甲醛與新制Cu(OH)2的堿性溶液反應生成Cu2O沉淀。
①甲醇的沸點比甲醛的高,其主要原因是______________;甲醛分子中碳原子軌道的雜化類型為________。
②甲醛分子的空間構型是________;1 mol甲醛分子中σ鍵的數目為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表為元素周期表前三周期的一部分:
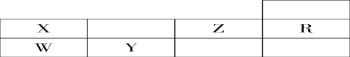
(1)判斷X __________ Y __________ Z __________W__________R ________(寫元素符號)。
(2)寫出X的氫化物的化學式;__________,W的氫化物的化學式__________,其沸點比較:__________>________(填化學式)
(3)下圖是X的基態原子的電子排布圖,其中有一個是錯誤的,它不能作為基態原子的電子排布圖是因為它不符合________。
①![]()
②![]()
(4)以上五種元素中,________(填元素符號)元素第一電離能最大。__________元素電負性最大,Y的基態原子的電子排布式為__________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在酸性條件下,黃鐵礦( FeS2)催化氧化的反應方程式為2FeS2+7O2+2H2O=2Fe2++4SO42-+4H+,實現該反應的物質間轉化如圖所示。下列分析錯誤的是
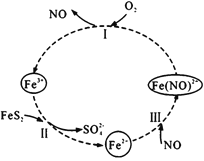
A.反應I的離子方程式為4Fe(NO)2++O2+4H+= 4Fe3++4NO+2H2O
B.反應Ⅱ的氧化劑是Fe3+
C.反應Ш是氧化還原反應
D.黃鐵礦催化氧化中NO作催化劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.實驗室配制90mL 1 mol·L-1的NaOH溶液:
(1)用托盤天平稱量NaOH的質量為________g。
(2)配制該溶液時需用的主要儀器有燒杯、玻璃棒、膠頭滴管、_______________等。
(3)誤差下列情況使配制結果偏大的是________。
A.溶解后未冷卻即轉移、定容
B.定容時仰視容量瓶刻度線
C.用膠頭滴管向容量瓶中加水時溶液凹面高于容量瓶刻度,此時立即用滴管將瓶內液體吸出,使溶液凹液面與刻度相切
D.托盤天平砝碼生銹
E.容量瓶內殘有少量蒸餾水
Ⅱ. 某同學學習了鐵及其化合物的性質,欲設計實驗研究鐵及其化合物的部分性質。
(1)該同學根據下圖裝置做相關實驗,請回答下列問題:
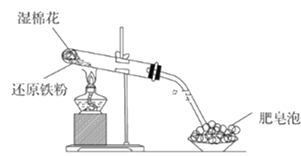
①硬質試管中發生反應的化學方程式為_______________。
②該同學將硬質試管冷卻后的少量固體物質溶于稀鹽酸得溶液A,向溶液A中滴加KSCN溶液,若溶液未變紅色,原因是:________________(用離子方程式表示)。
③該同學向溶液A中滴入一定量的氯水,用該所得溶液腐蝕刻銅板制電路板的主要反應離子方程式___________。
(2)該同學用如下圖所示裝置制取Fe(OH)2,實驗時使用鐵屑、6 mol/L硫酸,其他試劑任選。回答下列問題:
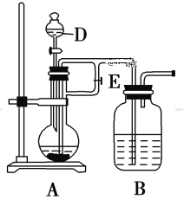
向儀器D中需要放入硫酸,裝置B中盛有一定量的NaOH溶液,A中盛有鐵屑,實驗開始時應先將活塞E打開,待裝置中空氣排盡后,將活塞E關閉,一段時間后能夠長時間觀察到裝置B中的白色沉淀原因是_____;待A中停止反應后,觀察到裝置B的白色沉淀,迅速變成灰綠色,最后變成紅褐色的現象,寫出B中出現該現象的反應方程式______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA表示阿伏加德羅常數的值,下列說法錯誤的是
A.標準狀況下,以任意比混合的氫氣和一氧化碳氣體共8.96L,在足量氧氣中充分燃燒時消耗氧氣的分子數為0.2NA
B.用惰性電極電解硫酸銅溶液時,若溶液的pH值變為1時,則電極上轉移的電子數目為NA
C.32.5 g鋅與一定量濃硫酸恰好完全反應,生成氣體的分子數為0.5NA
D.反應3H2(g)+N2(g)![]() 2NH3(g) ΔH=-92 kJ·mol-1,當放出熱量9.2 kJ時轉移電子0.6NA
2NH3(g) ΔH=-92 kJ·mol-1,當放出熱量9.2 kJ時轉移電子0.6NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】新合成的一種烴,其碳架呈三棱柱體(如圖所示),稱為棱晶烷。
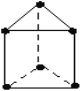
(1)寫出該烴的分子式為_____________。
(2)該烴的一氯取代物有_________種,二氯取代物有______種。
(3)該烴的同分異構體有多種,其中1種不能使酸性高錳酸鉀溶液或Br2-CCl4溶液褪色,但在一定條件下能跟溴(或H2)發生取代(或加成)反應,寫出在濃硫酸作用下,這種同分異構體與濃硝酸反應的化學方程式______________________________________________。
(4)有同學認為棱晶烷與立方烷( 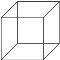 )互為同系物,判斷這種觀點是否正確并說明理由_______________________________。
)互為同系物,判斷這種觀點是否正確并說明理由_______________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com