
【題目】CaCO3與稀鹽酸反應(放熱反應)生成CO2的量與反應時間的關系如圖所示.下列結論不正確的是( ) 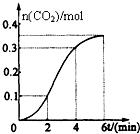
A.反應開始2分鐘內平均反應速率最大
B.反應4分鐘后平均反應速率最小
C.反應開始4分鐘內溫度對反應速率的影響比濃度大
D.反應4分鐘后反應速率下降的原因是鹽酸濃度逐漸減小
 互動課堂系列答案
互動課堂系列答案 激活思維智能訓練課時導學練系列答案
激活思維智能訓練課時導學練系列答案科目:高中化學 來源: 題型:
【題目】關于吸熱反應和放熱反應,下列說法中錯誤的是
A. 反應物的總能量高于生成物的總能量時,發生放熱反應
B. 需要加熱才能進行的化學反應一定是吸熱反應
C. 化學反應中的能量變化,除了熱量變化外,還可以轉化為光能、電能等
D. 化學反應過程中的能量變化,服從能量守恒定律
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知下列熱化學方程式,且b>a。
Hg(I)+![]() O2(g)===HgO(s) △H=-akJ·mol-1
O2(g)===HgO(s) △H=-akJ·mol-1
Zn(s)+![]() O2(g)===ZnO(s) △H=-bkJ·mol-1
O2(g)===ZnO(s) △H=-bkJ·mol-1
由此可知反應Zn(s)+HgO(s) ![]() ZnO(s)+Hg(l)的焓變為
ZnO(s)+Hg(l)的焓變為
A. -(b-a) kJ·mol-1 B. +(b-a) kJ·mol-1
C. (b-a) kJ·mol-1 D. (b+a)kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子可以大量共存的是
A. K+ SO42- Na+ HCO3- B. K+ Ag+ Cl- NO3-
C. Ba2+ Na+ OH- CO32- D. Al3+ NH4+ NO3- OH-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】恒溫恒容下,將2mol氣體A和2mol氣體B通入體積為2L的密閉容器中,發生如下反應:2A(g)+B(g)xC(g)+2D(s),2min后反應達到平衡狀態,此時剩余1.2molB,并測得C的濃度為1.2mol/L.
(1)從開始反應至達到平衡狀態,生成C的平均反應速率為 .
(2)x= .
(3)A的轉化率與B的轉化率之比為
(4)下列各項可作為該反應達到平衡狀態的標志是(填字母).
A.壓強不再變化
B.氣體密度不再變化
C.氣體平均相對分子質量不再變化
D.A的消耗速率與B的消耗速率之比為2:1.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳、氮及其化合物在生產生活中有著重要作用。請回答下列問題:
(1)用CH4 催化還原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) ![]() 4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1;
4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1;
CH4(g) + 4NO(g) ![]() 2N2(g)+CO2(g) + 2H2O(g) ΔH2。
2N2(g)+CO2(g) + 2H2O(g) ΔH2。
若2 mol CH4 還原NO2 至N2,整個過程中放出的熱量為1 734 kJ,則ΔH2=____。
(2)據報道,科學家在一定條件下利用Fe2O3與甲烷反應可制取“納米級”的金屬鐵。其反應為Fe2O3(s) + 3CH4(g)![]() 2Fe(s) + 3CO(g) +6H2(g) ΔH>0。
2Fe(s) + 3CO(g) +6H2(g) ΔH>0。
①若該反應在恒溫恒壓容器中進行,能表明該反應達到平衡狀態的是____(填字母)。
a.CH4的轉化率等于CO的產率
b.混合氣體的平均相對分子質量不變
c.v(CO)與v(H2#)的比值不變
d.固體的總質量不變
②該反應達到平衡時某物理量隨溫度的變化如圖所示,當溫度由T1升高到T2時,平衡常數KA___KB(填“>”、“<”或“=”)。縱坐標可以表示的物理量有哪些___________。

a.H2的逆反應速率
b.CH4的體積分數
c.混合氣體的平均相對分子質量
(3)若向20 mL 0.01 mol·L-l的弱酸HNO2溶液中逐滴加入一定濃度的燒堿溶液,測得混合溶液的溫度變化如圖所示,下列有關說法正確的是____(填字母)。

a.該燒堿溶液的濃度為0.02 mol·L-1
b.該燒堿溶液的濃度為0.01 mol·L-1
c.HNO2的電離平衡常數:b點>a點
d.從b點到c點,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列事實可以用勒夏特列原理解釋的是( )
A. 新制的氯水在光照條件下顏色變淺
B. 使用催化劑,提高合成氨的產量
C. 高錳酸鉀(KMnO4)溶液加水稀釋后顏色變淺
D. H2、I2、HI平衡混合氣體加壓后顏色變深
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列開發利用自然資源制取化學品,其簡示途徑較為合理的是( )
A.海水 ![]()
![]() Br2
Br2
B.海產品(如海帶等) ![]()
![]() 濾液
濾液 ![]()
![]()
![]() I2
I2
C.海水 ![]() Mg(OH)2
Mg(OH)2 ![]() MgO
MgO ![]() Mg
Mg
D.鋁土礦 ![]() 濾液
濾液 ![]() Al(OH)3
Al(OH)3 ![]()
![]() Al
Al
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com