
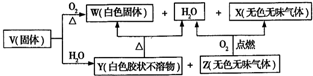
分析 X是導致溫室效應的主要氣體,應為CO2,Z是天然氣的主要成分,應為CH4,Y、W都既能與酸反應,又能與強堿溶液反應,應為兩性化合物,由轉化關系可知Y為Al(OH)3,W為Al2O3,則V中含有C、Al、H元素,原子個數比為1:3:9,應為Al(CH3)3,
(1)W為Al2O3,熔點高,可用于高溫耐火材料或冶煉金屬鋁;
(2)VAl(CH3)3,與足量NaOH溶液反應生成和甲烷;
(3)將過量的NaAlO2通入某種物質的水溶液中可以生成Al(OH)3,應通入二氧化碳;
(4)4g甲烷為0.25mol,0.25mol甲烷完全燃燒生成液態水時放出222.5KJ熱量,1mol甲烷反應燃燒反應放熱$\frac{222.5}{0.25}$=890KJ;
(5)4.48L CO2通入到200mL 1.5mol/LNaOH溶液中,二氧化碳的物質的量=$\frac{4.48L}{22.4L/mol}$=0.2mol,氫氧化鈉的物質的量1.5mol/L×0.2L=0.3mol,
當1<n(NaOH):n(CO2)<2時,生成物是碳酸鈉和碳酸氫鈉,方程式為2CO2+3NaOH=Na2CO3+NaHCO3+H2O,以此判斷;
(6)將0.01mol Al(OH)3投入1L某濃度的鹽酸中,則至少需要0.03mol,為使Al(OH)3完全溶解得到澄清透明溶液,反應后c(OH-)=$\root{3}{\frac{1.25×1{0}^{-33}}{0.01}}$mol/L=0.5×10-10mol/L,則c(H+)=2×10-4mol/L.
解答 解:X是導致溫室效應的主要氣體,應為CO2,Z是天然氣的主要成分,應為CH4,Y、W都既能與酸反應,又能與強堿溶液反應,應為兩性化合物,由轉化關系可知Y為Al(OH)3,W為Al2O3,則V中含有C、Al、H元素,原子個數比為1:3:9,應為Al(CH3)3,
(1)W為Al2O3,熔點高,可用于高溫耐火材料或冶煉金屬鋁,故答案為:高溫耐火材料或冶煉金屬鋁;
(2)VAl(CH3)3,與足量NaOH溶液反應生成和甲烷,反應的化學方程式Al(CH3)3+NaOH+H2O=NaAlO2+3CH4↑,
故答案為:Al(CH3)3+NaOH+H2O=NaAlO2+3CH4↑;
(3)將過量的NaAlO2通入某種物質的水溶液中可以生成Al(OH)3,應通入二氧化碳,反應的離子方程式為AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案為:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)4g甲烷為0.25mol,0.25mol甲烷完全燃燒生成液態水時放出222.5KJ熱量,1mol甲烷反應燃燒反應放熱$\frac{222.5}{0.25}$=890KJ,反應的熱化學方程式為:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890KJ/mol;
故答案為:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890KJ/mol;
(5)4.48L CO2通入到200mL 1.5mol/LNaOH溶液中,二氧化碳的物質的量=$\frac{4.48L}{22.4L/mol}$=0.2mol,氫氧化鈉的物質的量1.5mol/L×0.2L=0.3mol,
當1<n(NaOH):n(CO2)<2時,生成物是碳酸鈉和碳酸氫鈉,
根據二氧化碳和氫氧化鈉物質的量之間的關系得方程式為2CO2+3NaOH=Na2CO3+NaHCO3+H2O,根據方程式知,碳酸鈉和碳酸氫鈉的物質的量相等,碳酸根離子和碳酸氫根離子水解而使溶液呈堿性,則c(OH-)>c(H+),碳酸根離子的水解能力大于碳酸氫根離子,所以c(HCO3-)>c(CO32-),鈉離子不水解,離子濃度最大,所以離子濃度大小順序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案為:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(6)Al(OH)3是一種難溶物質,其溶度積常數為1.25×10-33.將0.01mol Al(OH)3投入1L某濃度的鹽酸中,則至少需要0.03mol,為使Al(OH)3完全溶解得到澄清透明溶液,反應后c(OH-)=$\root{3}{\frac{1.25×1{0}^{-33}}{0.01}}$mol/L=0.5×10-10mol/L,則c(H+)=2×10-4mol/L,鹽酸溶液的體積為1L,所以需要鹽酸的濃度為0.03mol/L+2×10-4mol/L=3.02×10-2mol/L,
故答案為:3.02×10-2mol/L.
點評 本題考查無機物的推斷,為高頻考點和常見題型,側重于學生的分析、計算能力的考查,注意把握常見物質的性質、用途和反應特征為解答該類題目的關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| 溶質 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
| A. | CO2+H2O+2NaClO→Na2CO3+2HclO | |
| B. | HCN+Na2CO3→CO2+2NaCN+H2O | |
| C. | 結合質子能力由強到弱的順序為:CO32->HCO3->CH3COO- | |
| D. | 常溫下電離常數比較:Ki1(H2CO3)>Ki2(H2CO3)>Ki(C6H5OH) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | C2H4 | B. | CH4 | C. | C2H2 | D. | C2H6 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1molCH4 分子中含 10NA個電子 | B. | 22.4LCH4 分子中含 4NA 個共價鍵 | ||
| C. | 乙烯不能使溴水褪色 | D. | 苯屬于烯烴 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
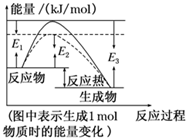 可逆反應N2+3H2?2NH3是工業上合成氨的重要反應.
可逆反應N2+3H2?2NH3是工業上合成氨的重要反應.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1.0mol/L | B. | 2.0mol/L | C. | 3.0mol/L | D. | 4.0mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na2CO3溶液 | B. | AgNO3溶液 | C. | NaOH溶液 | D. | BaCl2溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Al3+、NH4+、NO3-、Cl- | B. | Br-、Fe2+、Fe3+、SO42- | ||
| C. | Na+、SO32-、K+、NO3- | D. | K+、Na+、I -、NO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
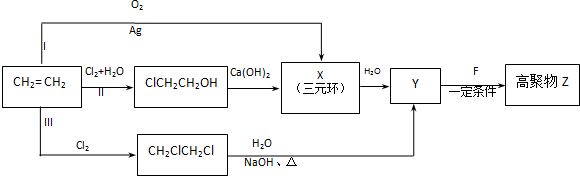
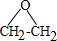 .
.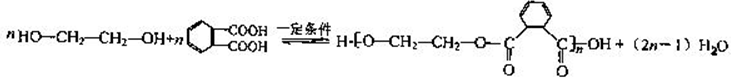 CH2ClCH2Cl→Y:CH2ClCH2Cl+2NaOH$→_{△}^{水}$CH2OHCH2OH+2NaCl.
CH2ClCH2Cl→Y:CH2ClCH2Cl+2NaOH$→_{△}^{水}$CH2OHCH2OH+2NaCl.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com