
【題目】將1 mol I2(g)和2 mol H2置于2L密閉容器中,在一定溫度下發生反應:I2(g) + H2(g) ![]() 2HI(g);△H<0,并達平衡。HI的體積分數w(HI)隨時間變化如圖曲線(Ⅱ)所示:
2HI(g);△H<0,并達平衡。HI的體積分數w(HI)隨時間變化如圖曲線(Ⅱ)所示:
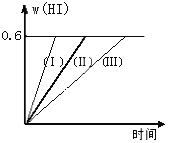
(1)達平衡時,I2(g)的物質的量濃度為____________________。
(2)若改變反應條件,在甲條件下w(HI)的變化如曲線(Ⅰ)所示,在乙條件下w(HI)的變化如曲線(Ⅲ) 所示。則甲條件可能是____________,則乙條件可能是_____________ 。(填入下列條件的序號)
①恒容條件下,升高溫度;②恒容條件下,降低溫度;③恒溫條件下,縮小反應容器體積;
④恒溫條件下,擴大反應容器體積;⑤恒溫恒容條件下,加入適當催化劑。
(3)若保持溫度不變,在另一個相同的2L密閉容器中加入a mol I2(g)、b mol H2(g)和c mol HI(a、b、c均大于0),發生反應,達平衡時,HI的體積分數仍為0.6,則a、b、c的關系是____________。
【答案】 0.05mol·L-1 ③⑤ ④ (a+c/2)/(b+c/2)=1/2
【解析】試題分析:(1)該反應是一個反應前后氣體體積不變的化學反應,所以反應后混合氣體的物質的量是3mol,同一容器中各種氣體的體積分數等其物質的量分數,所以平衡時碘化氫的物質的量=3mol×0.6=1.8mol,則參加反應的n(I2)=0.5n(HI)=0.5×1.8=0.9mol,剩余的n(H2)=1-0.9=0.1mol,所以平衡時c(H2)=![]() =0.05mol/L,故答案為:0.05mol/L;
=0.05mol/L,故答案為:0.05mol/L;
(2)在甲條件下w(HI)的變化如曲線(Ⅰ) 所示,反應時間縮短,碘化氫的含量不變,說明該條件只增大了反應速率不影響平衡,增大壓強(縮小反應容器體積)和加入催化劑對該反應平衡無影響,但都增大反應速率,縮短反應時間;在乙條件下w(HI)的變化如曲線(Ⅲ) 所示,反應時間變長,碘化氫的含量不變,說明反應速率減小,平衡不移動,所以是減小壓強(擴大容器體積),故答案為:③⑤;④;
(3)若保持溫度不變,在另一個相同的2L密閉容器中加入a mol I2(g)、b mol H2(g)和c mol HI(a、b、c均大于0),發生反應,達平衡時,HI的體積分數仍為0.6,與原來的平衡是等效平衡,恒溫恒容,前后氣體體積不變化,按化學計量數轉化到左邊,滿足與原來加入的反應物物質的量比例相等即可;
I2(g) + H2(g)![]() 2HI(g);
2HI(g);
開始(mol):a b c
變化(mol):0.5c 0.5c c
平衡(mol):a+0.5c b+0.5c 0
則(a+0.5c ):( b+0.5c)=1:2,所以4a+c=2b,故答案為:4a+c=2b。


科目:高中化學 來源: 題型:
【題目】下列措施能明顯增大原反應的化學反應速率的是( )
A.Na與水反應時增大水的用量
B.將稀H2SO4改為98%的濃H2SO4與鐵反應制取H2
C.在H2SO4與NaOH兩溶液反應時,增大壓強
D.恒溫恒容條件下,在工業合成氨反應中,增加氮氣的量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某粉末狀試樣A是等物質的量的MgO和Fe2O3的混合物。取適量A進行鋁熱反應,產物中有單質B生成。產物中的單質B是__________(填化學式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】白磷和紅磷的著火點分別是40℃、240℃根據如圖所示填空:
(1)銅片上燃燒;
(2)該實驗證明,燃燒必須同時具備以下條件:①;②氧氣(或空氣);③ .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某元素原子的最外電子層上只有2個電子,該元素是
A. 一定是IIA元素 B. 一定是金屬元素
C. 一定是正二價元素 D. 可能是金屬元素,也可能是非金屬元素
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】
三硫化四磷是黃綠色針狀結晶,其結構如圖所示.不溶于冷水,溶于疊氮酸、二硫化碳、苯等有機濟劑,在沸騰的NaOH稀溶液中會迅速水解。回答下列問題:

(1)Se是S的下一周期同主族元素,其核外電子排布式為_______。
(2)第一電離能:S____(填“>”或“<”,下同)P,電負性:S____P
(3)三硫化四磷分子中P原子采取______雜化,與PO3-互為等電子體的化合物分子的化學式為______。
(4)二硫化碳屬______(填“極性”或“非極性”)分子。
(5)用NA表示阿伏伽德羅常數的數值,0.1mol三硫化四磷分子中含有的孤電子對數為____。
(6)純疊氮酸(HN3)在常溫下是一種液體,沸點較高,為308.8K,主要原因是________。
(7)氫氧化鈉具有NaCl型結構,其晶胞中Na+與OH-之間的距離為acm ,晶胞中Na+的配位數為_______,用NA表示阿伏伽德羅常數的數值,NaOH的密度為_____g/cm3。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮及其化合物如NH3及銨鹽、N2H4、N2O4等在中學化學、化工工業、國防等領域占有重要地位。
(1)發射航天火箭常用肼(N2H4)與N2O4作燃料與助燃劑。N2H4 (1)與N2O4(g)生成4 mol H2O(g)時放出熱量1077 kJ,寫出其熱反應方程式:_____________________________________。
(2)N2O4與NO2之間存在反應N2O4(g)![]() 2NO2 (g)將一定量的 N2O4放入恒容密閉容器中,測得其平衡轉化率[a(N2O4)]隨溫度的變化如圖所示。
2NO2 (g)將一定量的 N2O4放入恒容密閉容器中,測得其平衡轉化率[a(N2O4)]隨溫度的變化如圖所示。
①由圖推測該反應ΔH_______0(填“>”或“<”),理由為__________________________。
②圖中a點對應溫度下,已知N2O4的起始壓強p0為108 kPa,列式計算該溫度下反應的平衡常數Kp =____________。(保留一位小數,并帶單位。用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)
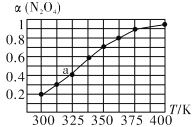
③在一定條件下,該反應N2O4、NO2兩者的消耗速率與自身壓強間存在關系:v消耗(N2O4)=k1· P(N2O4),v消耗(NO2)=k2·P2(NO2),其中k1、k2是與反應溫度有關的速率常數。則一定溫度下,k1、k2與平衡常數Kp的關系是k1=________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com