
【題目】已知同溫度同濃度時,下列微粒的電離程度由大到小的順序是H2CO3>H2S>HCO![]() >HS-,則下列說法正確的是( )
>HS-,則下列說法正確的是( )
A.氫硫酸的酸性強于碳酸B.反應Na2CO3+H2S = NaHCO3+NaHS能夠發生
C.CO![]() 結合H+的能力強于S2-D.同溫度時,同濃度的NaHS的pH大于Na2S
結合H+的能力強于S2-D.同溫度時,同濃度的NaHS的pH大于Na2S
 一線名師提優試卷系列答案
一線名師提優試卷系列答案科目:高中化學 來源: 題型:
【題目】已知反應:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
(1)參加反應的HNO3和作為氧化劑的HNO3的個數比為________。
(2)若有64 g Cu被氧化,則被還原的HNO3的質量是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ca(NO2)2(亞硝酸鈣)是易溶于水的無色晶體,可用作混凝土中鋼筋的防護劑。
(1)Ca(NO2)2的制備方法很多。
①實驗室可用反應Ca(NO3)2+2CaFe2O4+4NO![]() 3Ca(NO2)2+2Fe2O3制備Ca(NO2)2,該反應中被氧化的N原子與被還原的N原子的物質的量之比為_____。
3Ca(NO2)2+2Fe2O3制備Ca(NO2)2,該反應中被氧化的N原子與被還原的N原子的物質的量之比為_____。
②用石灰乳吸收硝酸工業尾氣中氮氧化物制備Ca(NO2)2,其中NO2與Ca(OH)2反應生成Ca(NO2)2和Ca(NO3)2的化學方程式為_____,經過濾得到含Ca(NO2)2的溶液為液態產品。
(2)測定某液態產品中NO3-含量的步驟如下:
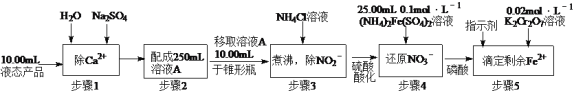
已知:步驟4中的反應為NO3—+3Fe2++4H+=3Fe3++NO↑+2H2O,
步驟5中的反應為6Fe2++Cr2O72—+14H+=6Fe3++2Cr3++7H2O。
若步驟5滴定至終點時消耗K2Cr2O7溶液20.00mL,計算液態產品中NO3-的含量(單位g·L-1,最后結果保留一位小數,寫出計算過程)___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知反應:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
(1)參加反應的HNO3和作為氧化劑的HNO3的個數比為________。
(2)若有64 g Cu被氧化,則被還原的HNO3的質量是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物分子中原子間(或原子與原子團間)的相互影響會導致物質化學性質的不同。下列事實不能說明上述觀點的是
A.乙烯能發生加成反應,乙烷不能發生加成反應
![]() B.苯酚能跟NaOH溶液反應,乙醇不能與NaOH溶液反應
B.苯酚能跟NaOH溶液反應,乙醇不能與NaOH溶液反應
C.甲苯能使酸性高錳酸鉀溶液褪色,苯不能使酸性高錳酸鉀溶液褪色
D.苯與硝酸在加熱時發生取代反應,甲苯與硝酸在常溫下就能發生取代反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗操作、現象和所得結論均正確的是( )
選項 | 實驗內容 | 實驗結論 |
A | 向盛有5mL0.005mol/L FeCl3溶液中加入5mL0.01mol/LKSCN溶液,再繼續加入少量KCl固體,觀察現象 | 證明溶液存在平衡: FeCl3+3KSCNFe(SCN)3+3KCl |
B | 取兩只試管,分別加入等體積等濃度的雙氧水,然后試管①中加入0.01mol/LFeCl3溶液2mL,試管②中加入0.01mol/LCuCl2溶液2mL,試管①產生氣泡快 | 加入FeCl3時,雙氧水分解反應的活化能較大 |
C | 檢驗FeCl3溶液中是否含有Fe2+時,將溶液滴入酸性KMnO4溶液,溶液紫紅色褪去 | 不能證明溶液中含有Fe2+ |
D | 取兩只試管分別加入4mL0.01mol/LKMnO4酸性溶液,然后向一只試管中加入0.01mol/L H2C2O4溶液2mL,向另一只試管中加入0.01mol/L H2C2O4溶液4mL,第一只試管中褪色時間長 | H2C2O4濃度越大,反應速率越快 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用KMnO4氧化鹽酸溶液,反應方程式如2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O,若產生的Cl2在標準狀況下體積為56 L,計算:
(1)參加反應的HCl的物質的量________________
(2)反應中被氧化的HCl的物質的量__________________
(3)并用雙線橋標出電子轉移的方向和數目___________________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究小組利用如圖裝置探究SO2和Fe(NO3)3溶液的反應原理。下列說法錯誤的是( )
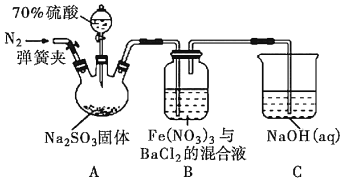
A.裝置B中若產生白色沉淀,說明Fe3+能將SO2氧化成SO![]()
B.實驗室中配制加70%的硫酸需要的玻璃儀器有量筒、燒杯、玻璃棒
C.三頸燒瓶中通入N2的操作應在滴加濃硫酸之前,目的是排盡裝置內的空氣
D.裝置C可能發生倒吸,同時還不能完全吸收反應產生的尾氣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)寫出下列物質在水溶液中的電離方程式:
CH3COOH____HClO4_____
Fe(OH)3____Ba(OH)2_____
NaHSO4____
(2)常溫下2.3g乙醇和一定量的氧氣混合,點燃恰好完全燃燒,生成液態水和CO2放出68.35kJ熱量,則該反應的熱化學方程式為:___。
(3)根據下列熱化學方程式分析,C(s)的燃燒熱△H等于___。
C(s)+H2O(l)=CO(g)+H2(g) △H1=+175.3kJ·mol-1
2CO(g) + O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
2H2(g) + O2(g)=2H2O(l) △H3=-571.6kJ·mol-1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com