
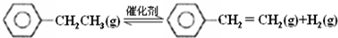
| 化學鍵 | C-H | C-C | C=C | H-H |
| 鍵能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
分析 (1)反應熱=反應物總鍵能-生成物總能鍵能,由有機物的結構可知,應是-CH2CH3中總鍵能與-CH=CH2、H2總鍵能之差;
(2)參加反應的乙苯為nα mol,則: ?
? +H2
+H2
開始(mol):n 0 0
轉化(mol):nα nα nα
平衡(mol):n(1-α) nα nα
維持體系總壓強p恒定,在溫度T時,由PV=nRT可知,混合氣體總濃度不變,設反應后的體積為V′,則$\frac{n(1-α)+nα+nα}{V}$=$\frac{n}{V}$,故V′=(1+α)V,再根據平衡常數表達式K=$\frac{c(苯乙烯)×c(氫氣)}{c(乙苯)}$計算解答;
(3)①保持壓強不變,加入水蒸氣,容器體積應增大,等效為降低壓強,平衡向氣體體積增大的方向移動;
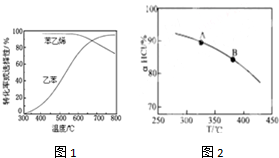
②600℃時乙苯的轉化率與苯乙烯的選擇性均較高;結合溫度對乙苯轉化率、苯乙烯選擇性、溫度對反應速率與催化劑的影響及消耗能量等,分析控制反應溫度為600℃的理由;
(4)①由圖可知,溫度越高,平衡時HCl的轉化率越小,說明升高溫度平衡向逆反應方向移動;
②正反應為氣體體積減小的反應,增大壓強,平衡向正反應方向移動,相同溫度下HCl的平衡轉化率比之前實驗的大;
③改變措施有利于提高αHCl,應使平衡向正反應方向移動,注意不能只增加HCl的濃度.
解答 解:(1)反應熱=反應物總鍵能-生成物總能鍵能,乙苯催化脫氫制苯乙烯反應:
由有機物的結構可知,應是-CH2CH3中總鍵能與-CH=CH2、H2總鍵能之差,故△H=(5×412+348-3×412-612-436)kJ•mol-1=+124kJ•mol-1,
故答案為:+124;
(2)物質的量為n、體積為V的乙苯蒸氣發生催化脫氫反應
參加反應的乙苯為nα mol,則:
 ?
? +H2
+H2
開始(mol):n 0 0
轉化(mol):nα nα nα
平衡(mol):n(1-α) nα nα
維持體系總壓強p恒定,在溫度T時,由PV=nRT可知,混合氣體總濃度不變,設反應后的體積為V′,則$\frac{n(1-α)+nα+nα}{{v}^{′}}$=$\frac{n}{V}$,故V′=(1+α)V,再根據平衡常數表達式K=$\frac{c(苯乙烯)×c(氫氣)}{c(乙苯)}$=$\frac{\frac{nα}{(1+α)v}×\frac{nα}{(1+α)v}}{\frac{n(1-α)}{(1+α)v}}$=$\frac{n{α}^{2}}{(1-{α}^{2})v}$,
故答案為:$\frac{n{α}^{2}}{(1-{α}^{2})v}$;
(3)①正反應為氣體分子數增大的反應,保持壓強不變,加入水蒸氣,容器體積應增大,等效為降低壓強,平衡向正反應方向移動,提高乙苯的平衡轉化率,
故答案為:正反應方向氣體分子數增加,加入水蒸氣起稀釋,相當于起減壓的效果;
②600℃時乙苯的轉化率與苯乙烯的選擇性均較高,溫度過低,反應速率較慢,轉化率較低,溫度過高,選擇性下降,高溫下可能失催化劑失去活性,且消耗能量較大,故選擇600℃左右,
故答案為:600℃時乙苯的轉化率與苯乙烯的選擇性均較高,溫度過低,反應速率較慢,轉化率較低,溫度過高,選擇性下降,高溫下可能使催化劑失去活性,且消耗能量較大.
(4)①由圖可知,溫度越高,平衡時HCl的轉化率越小,說明升高溫度平衡向逆反應方向移動,則正反應為放熱反應,即△H<0,化學平衡常數減小,即K(A)>K(B),
故答案為:K(A);
②正反應為氣體體積減小的反應,增大壓強,平衡向正反應方向移動,相同溫度下HCl的平衡轉化率比之前實驗的大,故壓縮體積使壓強增大,畫相應αHCl~T曲線的示意圖為: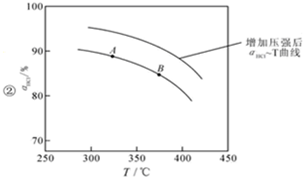 ,
,
故答案為: ;
;
③A.增大n(HCl),HCl濃度增大,平衡右移,但HCl的轉化率降低,故A錯誤;
B.增大n(O2),氧氣濃度增大,平衡右移,HCl的轉化率提高,故B正確;
C.使用更好的催化劑,加快反應速率,縮短到達平衡的時間,不影響平衡移動,HCl的轉化率不變,故C錯誤;
D.移去生成物H2O,有利于平衡右移,HCl的轉化率增大,故D正確;
故答案為:BD.
點評 本題考查反應熱計算、化學平衡常數計算、平衡移動的影響因素、對條件控制的分析評價等,(1)中應是-CH2CH3中總鍵能與-CH=CH2、H2總鍵能之差,(2)中平衡常數計算為易錯點、難點,注意溫度、壓強不變,容器的體積發生變化,學生容易認為容器的體積不變,(4)的難點為畫αHCl~T曲線,較好的考查的分析解決問題的能力,題目難度較大.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 對于C2H4 (g)+H2O(g)?C2H5OH(g),在一定條件下達到平衡狀態時,體系的總壓強為P,其中C2H4(g)、H2O(g)、C2H5OH(g)均為2 mol,則用分壓表示的平衡常數Kp=$\frac{3}{P}$ | |
| B. | 恒溫恒壓下,在一容積可變的容器中,N2(g)+3H2(g)?2NH3(g)達到平衡狀態時,N2、H2、NH3各1mol,若此時再充入3mol N2,則平衡正向移動 | |
| C. | 恒溫恒壓下,在一容積可變的容器中,反應2A(g)+B(g)?2C(g)達到平衡時,A、B和 C的物質的量分別為4mol、2mol和4mol,若此時A、B和C均減少1 mol,平衡逆向移動 | |
| D. | 對于一定條件下的某一可逆反應,用平衡濃度表示的平衡常數和用平衡分壓表示的平衡常數,其數值不同,但意義相同,都只與溫度有關 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 水中的鋼閘門連接電源的負極 | B. | 金屬護攔表面涂漆 | ||
| C. | 汽水底盤噴涂高分子膜 | D. | 地下鋼管連接鋅板 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 增大壓強,活化分子百分數不變,化學反應速率增大 | |
| B. | 升高溫度,活化分子百分數增大,化學反應速率增大 | |
| C. | 使用正催化劑,活化分子百分數增大,化學反應速率增大 | |
| D. | 加入反應物,活化分子百分數增大,化學反應速率增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
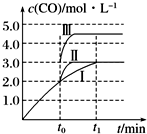 工業上可用CO或CO2來生產燃料甲醇.已知甲醇制備的有關化學反應以及在不同溫度下的化學反應平衡常數如下表所示:
工業上可用CO或CO2來生產燃料甲醇.已知甲醇制備的有關化學反應以及在不同溫度下的化學反應平衡常數如下表所示:| 化學反應 | 平衡 常數 | 溫度/℃ | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | ||
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 某課外小組設計的實驗室制取乙酸乙酯的裝置如圖所示,A中盛有濃H2SO4,B中盛有乙醇、無水醋酸鈉,D中盛有飽和碳酸鈉溶液.
某課外小組設計的實驗室制取乙酸乙酯的裝置如圖所示,A中盛有濃H2SO4,B中盛有乙醇、無水醋酸鈉,D中盛有飽和碳酸鈉溶液.| 試劑 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸點(℃) | 34.7 | 78.5 | 118 | 77.1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 瓜皮果殼--可回收垃圾 | B. | 塑料--危險廢物 | ||
| C. | 廚余垃圾--有機垃圾 | D. | 易拉罐--不可回收垃圾 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com