
【題目】已知NO2和N2O4可以相互轉化:2NO2(g)N2O4(g)(正反應為放熱反應).現將一定量NO2和N2O4的混合氣體通入一體積為2L的恒溫密閉容器中,反應物物質的量隨時間變化關系如圖所示,則下列說法錯誤的是( )
A.前10min內用NO2表示的化學反應速率v(NO2)=0.02mol/(Lmin)
B.反應進行至25min時,曲線發生變化的原因可以是向容器中添加NO2(g)
C.若要達到與最后相同的化學平衡狀態,在25min時還可以采取的措施是添加N2O4(g)
D.a、b、c、d四個點中,表示化學反應處于平衡狀態的點成是b和d
【答案】A
【解析】由圖可知0﹣10min平衡狀態時,X曲線△c=(0.6﹣0.2)mol/L=0.4mol/L,Y曲線△c=(0.6﹣0.4)mol/L=0.2mol/L,X曲線濃度變化量是Y曲線濃度變化量的2倍,則X曲線表示NO2濃度隨時間的變化曲線,Y曲線表示N2O4濃度隨時間的變化曲線;反應時NO2濃度增大,N2O4濃度減小,說明反應逆向進行;
A.前10min內用NO2表示的化學反應速率v(NO2)= ![]() =
= ![]() =0.04mol/(Lmin),A符合題意;
=0.04mol/(Lmin),A符合題意;
B.反應進行至25min時,c(NO2)增大、c(N2O4)不變,所以改變的條件可能是向容器中添加NO2(g),B不符合題意;
C.若要達到與最后相同的化學平衡狀態,在25min時還可以增大生成物平衡逆向移動來實現,C不符合題意;
D.如果各物質的濃度不變時,該可逆反應達到平衡狀態,根據圖知,bd點各物質濃度不變,說明正逆反應速率相等,反應達到平衡狀態,D不符合題意;
故答案為:A.
圖像題一定要注意橫軸與縱軸對應的物理量,結合化學定律進行分析。A.v(NO2)= ![]() 可由圖像得出△ c 與 △ t;B.反應進行至25min時,c(NO2)突變而c(N2O4)不變是關鍵;C.因該反應的特點是反應物與生成物均為一種,加入反應物和加入生成物可達到相同的平衡狀態;D.平衡狀態時各物質濃度不變。
可由圖像得出△ c 與 △ t;B.反應進行至25min時,c(NO2)突變而c(N2O4)不變是關鍵;C.因該反應的特點是反應物與生成物均為一種,加入反應物和加入生成物可達到相同的平衡狀態;D.平衡狀態時各物質濃度不變。


 學業測評一課一測系列答案
學業測評一課一測系列答案 小學課時作業全通練案系列答案
小學課時作業全通練案系列答案科目:高中化學 來源: 題型:
【題目】有機物D,質譜圖表明其相對分子質量為86,將8.6gD完全燃燒的產物依次通過裝有濃硫酸和堿石灰的裝置,濃硫酸中增重9g,堿石灰中增重22g.其相關反應如圖所示,其中B、D、E的結構中均含有2個﹣CH3 , 它們的核磁共振氫譜中均出現4個峰.
請回答:
(1)B中所含官能團的名稱為;D的分子式為;
(2)Ⅲ的反應類型為(填字母序號);
a.還原反應 b.加成反應 c.氧化反應 d.消去反應
(3)寫出下列反應的化學方程式:
Ⅰ:;
Ⅳ﹣:;
(4)C和E可在一定條件下反應生成F,F為有香味的有機化合物,該反應的化學方程式為;
(5)A的同分異構體中有一對互為順反異構,且結構中有2個﹣CH3 , 它們的結構簡式為和;
(6)E的另一種同分異構體能發生銀鏡反應,能與足量金屬鈉生成氫氣,不能發生消去反應,其結構簡式為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】目前世界上60%的鎂是從海水中提取的.主要步驟如下:
下列說法不正確的是( )
A. 為使海水中的MgSO4轉化成Mg(OH)2,試劑①可選擇石灰乳
B. 加入試劑①后,分離得到Mg(OH)2沉淀的方法是過濾
C. 加入試劑②反應的離子方程式為:OH﹣+H+=H2O
D. 通過電解熔融的無水MgCl2得到48gMg,共轉移4mol電子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】[化學--物質結構與性質]世上萬物,神奇可測。其性質與變化是物質的組成與結構發生了變化的結果。回答下列問題:
(1)根據雜化軌道理論判斷,下列分子的空間構型是V形的是____(填標號)。
A.BeCl2 B.H2O C.HCHO D.CS2
(2)原子序數小于36的元素Q和T,在周期表中既位于同一周期又位于同-一族,且T的原子序數比Q多2。T的基態原子的外圍電子(價電子)排布式為_____,Q2+的未成對電子數是_____.
(3)銅及其合金是人類最早使用的金屬材料,Cu2+能與NH3形成配位數為4的配合物[Cu(NH3)4]SO4。
①銅元素在周期表中的位置是______, [Cu(NH3)4]SO4中,N、O、S三種元素的第一電離能由大到小的順序為_______。
②[Cu(NH3)4]SO4中,存在的化學鍵的類型有_____(填標號)。
A.離子鍵 B.金屬鍵 C.配位鍵 D.非極性鍵 E.極性鍵
③NH3中N原子的雜化軌道類型是_____,寫出一種與SO42-互為等電子體的分子的化學式:_____________。
④[Cu(NH3)4]2+具有對稱的空間構型,[Cu(NH3)4]2+中的兩個NH3被兩個Cl-取代,能得到兩種不同結構的產物,則[Cu(NH3)4]2+的空間構型為_____________。
(4)CuO晶胞結構如圖所示。

該晶體的密度為ρg/cm3,則該晶體內銅離子與氧離子間的最近距離為_____ (用含ρ的代數式表示,其中阿伏加德羅常數用NA表示)cm。
(5)在Cu2O晶胞結構中,Cu處于正四面體空隙,O處于_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向絕熱恒容密閉容器中通入CO和H2O(g),在一定條件下使反應CO(g)+H2O(g)CO2(g)+H2(g)達到判平衡,正反應速率隨時間變化的示意圖如圖所示.由圖可得出的正確結論是( )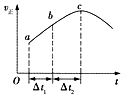
A.反應物的總能量低于生成物的總能量
B.△t1=△t2時,CO的轉化率:a~b段小于bc段
C.反應在c點達到平衡狀態
D.反應物濃度:a點小于b點
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上通常采用N2(g)和H2(g)崔華成NH3(g):N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1
(1)在一定溫度下,若將10amolN2和30amolH2放入2L的密閉容器中,充分反應后測得平衡時N2的轉化率為60%,則該反應的平衡常數為(用含a的代數式表示).若此時再向該容器中投入10amolN2、20amolH2和20amolNH3 , 判斷平衡移動的方向是(填“正向移動”“逆向移動”或“不移動”).
(2)若反應起始時N2、H2、NH3的濃度分別為0.1mol/L、0.3mol/L、0.1mol/L.則NH3達到平衡時濃度的范圍為;若平衡時N2、H2、NH3的濃度分別為0.1mol/L、0.3mol/L、0.1mol/L,則NH3起始時濃度的范圍為 .
(3)一定條件下,在容積相同的三個密閉容器中,按不同方式投入反應物,保持恒溫、恒容,測得反應達到平衡時的有關數據如表:
容器 | 甲 | 乙 | 丙 | |
反應物投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 | |
平衡時數據 | 反應能量變化的絕對值(kJ) | Q1 | Q2 | Q3 |
反應物轉化率 | a1 | a2 | a3 | |
體系壓強(Pa) | p1 | P2 | P3 | |
則Q1+Q2=kJ;a1+a2l(填“<”“>”或“=”下同):2p2p3
(4)如圖:A是恒容的密閉容器,B是一個體積可變的充氣氣囊.保持恒溫,關閉K2 , 將1molN2和3molH2通過K3充入B中,將2molN2和6molH2通過K1充入A中;起始時A、B的體積相同均為1L,達到平衡時,V(B)=0.9L;然后打開K2 , 一段時間又達到平衡時,B的體積為L(連通管中氣體體積不計).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某新型有機酰胺化合物M在工業生產中有重要的應用,其合成路線如下:

已知以下信息:
①A的相對分子質量為58,含氧的質量分數為0.552,已知核磁共振氫譜顯示為一組峰,可發生銀鏡反應。
② ![]()
③R—COOH ![]() R—COCl
R—COCl
④
⑤
請回答下列問題:
(1)A的名稱為____________,B中含有官能團名稱為_____________。
(2)C→D的反應類型為__________________,生成G的“條件a”指的是___________________。
(3)E的結構簡式為___________________。
(4)F+H→M的化學方程式為____________________________。
(5)芳香族化合物W有三個取代基,與C互為同分異構體,當W分別與Na、NaOH充分反應時,1mol W最多可消耗的Na、NaOH分別為2 mol、1mol。試分析W共有________種同分異構體,每一種同分異構體的核磁共振氫譜中有____________組峰。
(6)參照上述合成路線,以C2H4和HOCH2CH2OH為原料(無機試劑任選),設計制備 的合成路線___________________。
的合成路線___________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在400℃和2633kPa下,將1.5mol氙氣(Xe)和6mol氟氣(F2)混合,充分反應后冷卻至室溫,得到一種無色晶體并只剩余3mol氟氣,則所得無色晶體產物中,氟與氙的原子個數之比是
A.6:1B.4:1C.3:1D.2:1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上電解食鹽水的原理是:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。成品堿中含有氯化鈉雜質,可通過分光光度法測定每克成品堿中氯化鈉的含量,其測量值(吸光度A)與每克成品堿中氯化鈉含量的關系如下圖,氯化鈉雜質小于0.0050%的成品堿為優品級。下列說法不正確的是
2NaOH+H2↑+Cl2↑。成品堿中含有氯化鈉雜質,可通過分光光度法測定每克成品堿中氯化鈉的含量,其測量值(吸光度A)與每克成品堿中氯化鈉含量的關系如下圖,氯化鈉雜質小于0.0050%的成品堿為優品級。下列說法不正確的是

A. 吸光度A的值越大,樣品中氯化鈉含量越小
B. 分光光度法是對物質組成進行定性和定量的測定
C. 圖中G點所測的成品堿不是優品級
D. 成品堿是否含有NaCl,可用硝酸酸化的硝酸銀溶液檢驗
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com