
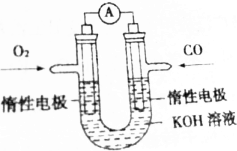
 某實驗小組將反應2CO(g)+O2(g)═2CO2(g)設計成如圖所示的電池裝置,負極的電極反應式為CO-2e-+2OH-=CO32-+H2O;正極的電極反應式為O2+2H2O+4e-=4OH-.電池工作時,正極區域溶液的pH變大(填“變大”“變小”或“不變”)用該原電池做電源,電解200mL飽和食鹽水(足量),消耗的標準狀況下的CO224mL,則溶液的pH=13.(不考慮溶液體積的變化)
某實驗小組將反應2CO(g)+O2(g)═2CO2(g)設計成如圖所示的電池裝置,負極的電極反應式為CO-2e-+2OH-=CO32-+H2O;正極的電極反應式為O2+2H2O+4e-=4OH-.電池工作時,正極區域溶液的pH變大(填“變大”“變小”或“不變”)用該原電池做電源,電解200mL飽和食鹽水(足量),消耗的標準狀況下的CO224mL,則溶液的pH=13.(不考慮溶液體積的變化) 分析 CO在負極失電子生成碳酸根離子,氧氣在正極得電子生成氫氧根離子;根據電極方程式判斷溶液pH的變化;電解飽和食鹽水的離子方程式為:2Cl-+2H2O=H2↑+Cl2↑+2OH-,根據轉移電子守恒計算溶液中的氫氧根離子濃度,再確定pH.
解答 解:將反應2CO(g)+O2(g)═2CO2(g)設計成如圖所示的電池裝置,CO在負極失電子生成碳酸根離子,則負極的電極方程式為:CO-2e-+2OH-=CO32-+H2O,氧氣在正極得電子生成氫氧根離子,則正極的電極方程式為:O2+2H2O+4e-=4OH-;電池工作時,正極上氧氣得電子生成氫氧根離子,所以正極區域溶液的pH變大;消耗的標準狀況下的CO24mL,則CO的物質的量為$\frac{0.224L}{22.4L/mol}$=0.01mol,則轉移電子為0.02mol,電解飽和食鹽水的離子方程式為:2Cl-+2H2O$\frac{\underline{\;通電\;}}{\;}$H2↑+Cl2↑+2OH-,由轉移電子守恒可知,生成的氫氧根離子的物質的量為0.02mol,則c(OH-)=0.1mol/L,所以pH=13.
故答案為:CO-2e-+2OH-=CO32-+H2O;O2+2H2O+4e-=4OH-;變大;13.
點評 本題考查原電池、電解池工作原理,題目難度中等,正確推斷燃料電池正負極是解本題的關鍵,難點是溶液的pH計算,根據電解飽和食鹽水的離子方程式分析解答.


科目:高中化學 來源: 題型:選擇題
| A. | ①>②>③>④ | B. | ①>②>④>③ | C. | ③>④>②>① | D. | ①=②=③=④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 濃鹽酸在反應中僅體現還原性 | |
| B. | 被氧化和被還原的物質的物質的量之比為1:1 | |
| C. | 每生成0.1molClO2轉移0.2mol電子 | |
| D. | 氧化性:NaClO3<Cl2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 某元素由化合態變為游離態時,該元素一定被還原 | |
| B. | 金屬陽離子被還原不一定得到金屬單質 | |
| C. | 生成非金屬單質的反應一定是氧化反應 | |
| D. | 在氧化還原反應中,非金屬單質一定是氧化劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 含SO2的煙氣可用石灰乳吸收后再排放,以減少對空氣污染 | |
| B. | 汽車尾氣、工業排放、建筑揚塵、垃圾焚燒等都是造成霧霾天氣的主要原因 | |
| C. | 綠色化學的核心是對環境產生的污染進行治理 | |
| D. | PM2.5由于顆粒小,在空氣中存在時間長,對人體健康危害大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 稀硝酸與足量的Fe反應的離子方程式:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| B. | 碳酸氫鈣溶液中加入過量的氫氧化鈉:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | 向碳酸鈣中加入稀鹽酸的離子方程式:CO32-+2H+═CO2↑+H2O | |
| D. | 硅酸鈉溶液中通入過量二氧化碳:CO2+SiO32-+H2O═H4SiO4↓+CO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com