
在一容積為2L的密閉容器中,加入0.2mol的N
2和0.6mol的H
2,在一定條件下發(fā)生反應(yīng):N
2(g)+3H
2(g)?2NH
3(g)△H<0.反應(yīng)中NH
3的物質(zhì)的量濃度的變化情況如下圖所示,請回答下列問題:
(1)根據(jù)上圖,計算從反應(yīng)開始到平衡時,氫氣的平均反應(yīng)速率v(H
2)為
0.0375mol/(L.min)
0.0375mol/(L.min)
.
(2)該反應(yīng)達(dá)到平衡時N
2的轉(zhuǎn)化率
50%
50%
.
(3)反應(yīng)達(dá)到平衡后,第5分鐘末,保持其它條件不變,若改變反應(yīng)溫度,則NH
3的物質(zhì)的量濃度不可能為
a
a
.(填序號)
a.0.20mol?L
-1 b.0.12mol?L
-1 c.0.10mol?L
-1 d.0.08mol?L
-1(4)請寫出該反應(yīng)的平衡常數(shù)表達(dá)式
,若該反應(yīng)在298K、398K時的化學(xué)平衡常數(shù)分別為K
1、K
2,則K
1>
>
K
2(填“>”、“=”或“<”).
(5)在第5分鐘末將容器的體積縮小一半后,若在第8分鐘末達(dá)到新的平衡(此時NH
3的濃度約為0.25mol?L
-1),請?jiān)谏蠄D中畫出第5分鐘末到此平衡時NH
3濃度的變化曲線.

 在一容積為2L的密閉容器中,加入0.2mol的N2和0.6mol的H2,在一定條件下發(fā)生反應(yīng):N2(g)+3H2(g)?2NH3(g)△H<0.反應(yīng)中NH3的物質(zhì)的量濃度的變化情況如下圖所示,請回答下列問題:
在一容積為2L的密閉容器中,加入0.2mol的N2和0.6mol的H2,在一定條件下發(fā)生反應(yīng):N2(g)+3H2(g)?2NH3(g)△H<0.反應(yīng)中NH3的物質(zhì)的量濃度的變化情況如下圖所示,請回答下列問題: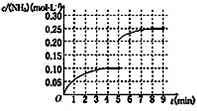 ,故答案為:
,故答案為: .
.

 閱讀快車系列答案
閱讀快車系列答案


 2NH3(g)+Q(Q>0),反應(yīng)中NH3的物質(zhì)的量濃度的變化情況如圖:
2NH3(g)+Q(Q>0),反應(yīng)中NH3的物質(zhì)的量濃度的變化情況如圖:


 在一容積為2L的密閉容器內(nèi)為加入 0.2mol的N2和0.6mol的H2,在一定條件下發(fā)生如下反應(yīng):N2(g)+3H2(g)?2NH3(g)△H<0反應(yīng)中NH3的物質(zhì)的量濃度的變化的情況如圖所示:
在一容積為2L的密閉容器內(nèi)為加入 0.2mol的N2和0.6mol的H2,在一定條件下發(fā)生如下反應(yīng):N2(g)+3H2(g)?2NH3(g)△H<0反應(yīng)中NH3的物質(zhì)的量濃度的變化的情況如圖所示: