
【題目】2SO2(g)+O2(g)![]() 2SO3(g)反應過程的能量變化如圖所示。已知1 mol SO2(g)氧化為1 mol SO3(g)的ΔH=﹣99 kJ mol-1。
2SO3(g)反應過程的能量變化如圖所示。已知1 mol SO2(g)氧化為1 mol SO3(g)的ΔH=﹣99 kJ mol-1。
請回答下列問題:
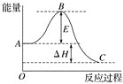
(1) 圖中ΔH=___kJ mol-1。
(2) 如果反應速率υ(SO2)為0.05 molL-1min-1,則υ(O2)=___ molL-1min-1、υ(SO3)=____ molL-1min-1;
(3) 已知單質硫的燃燒熱為296 kJ mol-1,計算由S(s)生成3 mol SO3(g)的ΔH=___kJ mol-1
【答案】-198 0.025 0.05 -1185
【解析】
(1) 圖中為2mol SO2(g)參與反應時的焓變;
(2)化學反應速率之比等于化學計量數之比;
(3) 根據單質硫的燃燒熱為296 kJ mol-1,及2SO2(g)+O2(g)![]() 2SO3(g)的焓變進行計算。
2SO3(g)的焓變進行計算。
(1) 圖中為2mol SO2(g)參與反應時的焓變,則ΔH=﹣99kJ/mol×2=-198 kJmol-1;
(2)化學反應速率之比等于化學計量數之比,υ(SO2):υ(O2)=2:1,則υ(O2)=0.025molL-1min-1;υ(SO2):υ(SO3)=1:1,則υ(SO3)=0.05 mol L-1min-1;
(3) 已知單質硫的燃燒熱為296 kJ mol-1,則S(s)+O2(g)=SO2(g)H=-296 kJ mol-1,2SO2(g)+O2(g)![]() 2SO3(g)H=-198 kJmol-1;生成3mol SO3(g)時,需要3molS(s)反應生成3mol SO2(g),則ΔH=-296kJ/mol×3-198kJ/mol×1.5=-1185 kJmol-1。
2SO3(g)H=-198 kJmol-1;生成3mol SO3(g)時,需要3molS(s)反應生成3mol SO2(g),則ΔH=-296kJ/mol×3-198kJ/mol×1.5=-1185 kJmol-1。


科目:高中化學 來源: 題型:
【題目】漢黃芩素是傳統中草藥黃芩的有效成分之一,對腫瘤細胞的殺傷有獨特作用。下列有 關漢黃芩素的敘述正確的是

A. 漢黃芩素的分子式為 C16H13O5
B. 該物質遇 FeCl3 溶液顯色
C. 1 mol 該物質與溴水反應,最多消耗 1 mol Br2
D. 與足量 H2 發生加成反應后,該分子中官能團的種類減少 1 種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應既是氧化還原反應,又是吸熱反應的是( )
A.鋁片與稀硫酸的反應
B.Ba(OH)2·8H2O與NH4Cl的反應
C.灼熱的炭與CO2的反應
D.甲烷在O2中的燃燒反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】合成聚丙烯腈纖維的方法很多,如以乙炔為原料,其合成過程的化學反應方程式
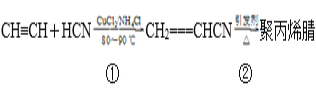
(1)反應①的反應類型為__________________________。
(2)寫出反應②的化學方程式:_________________________________。
(3)1mol合成聚丙烯腈的單體在一定條件下最多能與________molH2加成。
(4)CH2=CHCN在一定條件下可與苯乙烯(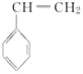 )反應得到一種優良的塑料,該塑料的結構簡式為_________________________________。
)反應得到一種優良的塑料,該塑料的結構簡式為_________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NaOH溶液吸收煙氣中的SO2,將所得的吸收液用三室膜電解技術處理,原理如圖所示.下列說法錯誤的是
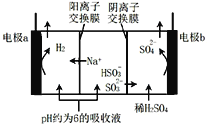
A.電極a為電解池陰極
B.陽極上有反應HSO3—-2e—+H2O=SO42—+3H+發生
C.當電路中通過1mol電子的電量時,理論上將產生0.5mol H2
D.處理后可得到較濃的H2SO4和NaHSO3產品
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海洋是資源的寶庫,醢藏著豐富的化學元素,如氯、溴、碘等,海洋資源的綜合利用具有非常廣闊的前景。
(1)下列說法正確的是_________。
a.AgCl、AgBr、AgI的顏色依次變深 b.F、Cl、Br、I的非金屬性依次增強
c.HF、HCl、HBr、HI的還原性的依次增強 d.F2、Cl2、Br2、I2與H2化合由難變易
(2)實驗室從海藻灰中提取少量碘的流程如下圖:
![]()
①氧化時,可以加入MnO2在酸性條件下進行氧化,反應的離子方程式為:_________。
②上述步驟①②③分離操作分別為過濾、_________、_________。
(3)從海水提取的粗鹽中含有Mg2+、Fe2+、Ca2+和SO42—等雜質,“除雜”所需試劑有:①過量的NaOH溶液②過量的Na2CO3溶液③適量的鹽酸④過量的BaCl2溶液.試劑的添加順序為_________。
為使Ca2+完全沉淀,溶液中c(CO32—)應不小于_________mol/L。[已知Ksp(CaCO3)=2.9×10-9,離子濃度小于1×10-5mol/L視為完全沉淀]
(4)目前,利用食鹽制取純堿主要有“氨堿法”和“聯合制堿法”兩種工藝
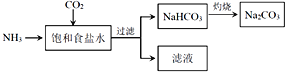
①能析出 NaHCO3的原因是_________。
②“氨堿法”是在濾液中加入_________產生NH3,循環使用,但產生大量的度棄物CaCl2;“聯合制堿法“是在濾液中繼續通入NH3,并加入NaCl粉末以制得更多的副產物_________。
③常溫下,向飽和食鹽水中通入NH3和CO2,當(HCO3—)=c(NH4+)時,溶液的pH_____7 (填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知常溫下,硫化物的沉淀在溶液中達溶解平衡時,金屬陽離子的濃度隨S2-濃度的變化曲線如圖所示。據圖判斷,下列說法錯誤的是 ( )
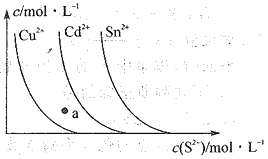
A.三種物質的溶度積大小為Ksp(CuS)<Ksp(CdS)<Ksp(SnS)
B.向SnS懸濁液中加入少量CuSO4固體,c(Sn2+)會減少
C.a點無CdS沉淀產生
D.向含等物質的量濃度的Cu2+、Sn2-的混合液中,滴加Na2S溶液,先析出CuS沉淀
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應N2+3H2![]() 2NH3剛開始時,N2的濃度為3 mol/L,H2的濃度為5 mol/L,3 min后測得NH3濃度為0.6 mol/L,則此時間內,下列反應速率表示正確的是
2NH3剛開始時,N2的濃度為3 mol/L,H2的濃度為5 mol/L,3 min后測得NH3濃度為0.6 mol/L,則此時間內,下列反應速率表示正確的是
A.v(NH3)=0.1mol/(L·s)B.v(N2)=1.0mol/(L·min)
C.v(H2)=1.67mol/(L·min)D.v(H2)=0.3mol/(L·min)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究金屬與硝酸的反應,實驗如下。
實驗 (20C) | 現象 |
Ⅰ | 無色氣體(遇空氣變紅棕色),溶液變為藍色 |
Ⅱ | 6mL無色氣體(經檢測為H2),溶液幾乎無色 |
⑴Ⅰ中產生的無色氣體是______。
⑵研究Ⅱ中的氧化劑
①甲同學認為該濃度的硝酸中H+的氧化性大于NO3-,所以NO3-沒有發生反應。乙同學依據Ⅰ和Ⅱ證明了甲的說法不正確,其實驗證據是______。
![]() 乙同學通過分析,推測出NO3-也能被還原,依據是______,進而他通過實驗證實該溶液中含有NH4+,其實驗操作是______。
乙同學通過分析,推測出NO3-也能被還原,依據是______,進而他通過實驗證實該溶液中含有NH4+,其實驗操作是______。
![]() 補全Ⅱ中NO3-被還原為
補全Ⅱ中NO3-被還原為![]() 的過程:NO3- + ______e- + ______= NH4+ + ______H2O
的過程:NO3- + ______e- + ______= NH4+ + ______H2O
⑶研究影響產生H2的因素
實驗 | 現象 |
Ⅲ | 3.4m L氣體(經檢測為H2),溶液略帶黃色 |
Ⅳ | 2.6m L氣體(經檢測為H2),黃色溶液 |
Ⅴ | 無色氣體(遇空氣變紅棕色),深棕色溶液 |
資料:Fe[(NO)]2+在溶液中呈棕色。 ④對比Ⅱ、Ⅲ、Ⅳ,溫度不同時收集到氫氣的體積不同,原因是______。 ⑤Ⅴ中無色氣體是混合氣體,則一定含有遇空氣變紅棕色的氣體和______。 ⑷根據實驗,金屬與硝酸反應時,影響硝酸的還原產物不同的因素有______。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com