
用已知物質的量濃度的鹽酸滴定未知物質的量濃度的NaOH溶液時,下列操作中正確的是( )
A.酸式滴定管用蒸餾水洗凈后,直接加入已知物質的量濃度的鹽酸
B.錐形瓶用蒸餾水洗凈后,先潤洗加入一定體積的未知物質的量濃度的NaOH溶液
C.滴定時,沒有逐出滴定管尖嘴的氣泡
D.讀數時,視線與滴定管內液體的凹液面最低處保持水平
D
【解析】
試題分析:滴定管未潤洗就直接加入標準液,會導致標準液物質的量濃度偏低,耗用體積偏大,代入計算公式,結果使所求待測液物質的量濃度偏高;錐形瓶不用待測液潤洗,因為待測液中溶質的物質的量一定,消耗的標準液的物質的量就一定;滴定時沒逐出尖嘴處的氣泡,會導至消耗標準液體積的讀數偏大,代入計算公式,結果所求待測液物質的量濃度偏高;讀數時視線應平視,故答案選D。
考點:考查中和滴定操作的正誤判斷
點評:該題是高考中的常見考點,屬于基礎性試題的考查,試題基礎性強,側重對學生基礎知識的鞏固和訓練,主要是考查學生對中和滴定原理以及操作的熟悉了解程度,旨在考查學生靈活運用基礎知識解決實際問題的能力,有利于培養學生的邏輯推理能力和規范嚴謹的實驗操作動手能力。


科目:高中化學 來源: 題型:
甲:①稱取一定質量的HA配制0.1 mol·L-1的溶液100 mL;
②用pH試紙測出該溶液pH,即可證明HA是弱電解質。
乙:①用已知物質的量濃度的HA溶液、鹽酸,分別配制pH=1的兩種酸溶液各100 mL;
②分別取這兩種溶液各10 mL,加水稀釋為100 mL;
③各取相同體積的兩種稀釋液裝入兩支試管,同時加入純度相同的鋅粒,觀察現象,即可證明HA是弱電解質。
(1)在兩個方案的第①步中,都要用到的定量儀器是____________。
(2)甲方案中,說明HA是弱電解質的理由是測得溶液的pH_________(填“<”“>”或“=”)1;乙方案中,說明HA是弱電解質的現象是_________。
A.裝HCl溶液的試管中放出H2的速率快
B.裝HA溶液的試管中放出H2的速率快
C.兩支試管中產生氣體速率一樣快
(3)請你評價:乙方案中難以實現之處和不妥之處是_____________________________。
(4)請你再提出一個合理而比較容易進行的方案(藥品可任取)。作簡明扼要表述。
查看答案和解析>>
科目:高中化學 來源: 題型:
甲:①稱取一定質量的HA配制0.1 mol·L-1的溶液100 mL;
②用pH試紙測出該溶液的pH,即可證明HA是弱電解質。
乙:①用已知物質的量濃度的HA溶液、鹽酸,分別配制pH=1的兩種酸溶液各100 mL;
②分別取這兩種溶液各10 mL,加水稀釋為100 mL;
③各取相同體積的兩種稀釋液裝入兩支試管,同時加入純度相同的鋅粒,觀察現象,即可證明HA是弱電解質。
(1)在兩個方案的第①步中,都要用的定量儀器是______________________。
(2)甲方案中,說明HA是弱電解質的理由是測得溶液的pH_________1(選填“>”“<”“=”);乙方案中,說明HA是弱電解質的現象是________(多選扣分)。( )
a.裝HCl溶液的試管中放出H2的速率快
b.裝HA溶液的試管中放出H2的速率快
c.兩個試管中產生氣體速率一樣快
(3)請你評價:乙方案中難以實現之處和不妥之處______________________。
(4)請你再提出一個合理而比較容易進行的方案(藥品可任取),作扼要表述。
查看答案和解析>>
科目:高中化學 來源: 題型:
某學生欲用已知物質的量濃度的鹽酸來測定未知物質的量濃度的NaOH溶液時,選擇甲基橙作指示劑。請填寫下列空白:
(1)用標準的鹽酸溶液滴定待測的NaOH溶液時,左手把握酸式滴定管的活塞,右手搖動錐形瓶,眼睛注視錐形瓶中溶液顏色的變化。直到因加入一滴鹽酸后,溶液由黃色變為橙色,并______ _________為止。
(2)若滴定開始和結束時,酸式滴定管中的液面如圖示,則所用鹽酸溶液的體積為___ _____ mL。
(3)下列操作中可能使所測NaOH溶液的濃度數值偏低的是_____________。
A.酸式滴定管未用標準液潤洗就直接注入標準鹽酸溶液
B.滴定前盛放NaOH溶液的錐形瓶用蒸餾水洗凈后沒干燥
C.酸式滴定管在滴定前有氣泡,滴定后氣泡消失
D讀取鹽酸體積時,開始仰視讀數,滴定結束時俯視讀數
(4)某學生根據三次實驗分別記錄有關數據如下表:
| 滴定次數 | 待測氫氧化鈉溶液的體積/mL | 0.1000mol·L-1鹽酸的體積/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液體積/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
請用上述數據計算該NaOH溶液的物質的量濃度。c(NaOH)= 。
查看答案和解析>>
科目:高中化學 來源:2010年湖北省襄樊市四校聯考-高二上學期期中考試化學卷 題型:填空題
某學生欲用已知物質的量濃度的鹽酸來測定未知物質的量濃度的NaOH溶液時,選擇甲基橙作指示劑。請填寫下列空白:
(1)用標準的鹽酸溶液滴定待測的NaOH溶液時,左手把握酸式滴定管的活塞,右手搖動錐形瓶,眼睛注視錐形瓶中溶液顏色的變化。直到因加入一滴鹽酸后,溶液由黃色變為橙色,并______ _________為止。
(2)若滴定開始和結束時,酸式滴定管中的液面如圖示,則所用鹽酸溶液的體積為___ _____ mL。
(3)下列操作中可能使所測NaOH溶液的濃度數值偏低的是_____________。
A.酸式滴定管未用標準液潤洗就直接注入標準鹽酸溶液
B.滴定前盛放NaOH溶液的錐形瓶用蒸餾水洗凈后沒干燥
C.酸式滴定管在滴定前有氣泡,滴定后氣泡消失
D讀取鹽酸體積時,開始仰視讀數,滴定結束時俯視讀數
(4)某學生根據三次實驗分別記錄有關數據如下表:
| 滴定次數 | 待測氫氧化鈉溶液的體積/mL | 0.1000mol·L-1鹽酸的體積/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液體積/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化學 來源:2010年湖北省襄樊市四校聯考-高二上學期期中考試化學卷 題型:填空題
某學生欲用已知物質的量濃度的鹽酸來測定未知物質的量濃度的NaOH溶液時,選擇甲基橙作指示劑。請填寫下列空白:
(1)用標準的鹽酸溶液滴定待測的NaOH溶液時,左手把握酸式滴定管的活塞,右手搖動錐形瓶,眼睛注視錐形瓶中溶液顏色的變化。直到因加入一滴鹽酸后,溶液由黃色變為橙色,并______ _________為止。
(2)若滴定開始和結束時,酸式滴定管中的液面如圖示,則所用鹽酸溶液的體積為___ _____ mL。
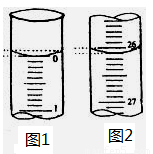
(3)下列操作中可能使所測NaOH溶液的濃度數值偏低的是_____________。
A.酸式滴定管未用標準液潤洗就直接注入標準鹽酸溶液
B.滴定前盛放NaOH溶液的錐形瓶用蒸餾水洗凈后沒干燥
C.酸式滴定管在滴定前有氣泡,滴定后氣泡消失
D讀取鹽酸體積時,開始仰視讀數,滴定結束時俯視讀數
(4)某學生根據三次實驗分別記錄有關數據如下表:
|
滴定次數 |
待測氫氧化鈉溶液的體積/mL |
0.1000mol·L-1鹽酸的體積/mL |
||
|
滴定前刻度 |
滴定后刻度 |
溶液體積/mL |
||
|
第一次 |
25.00 |
0.00 |
26.11 |
26.11 |
|
第二次 |
25.00 |
1.56 |
30.30 |
28.74 |
|
第三次 |
25.00 |
0.22 |
26.31 |
26.09 |
請用上述數據計算該NaOH溶液的物質的量濃度。c(NaOH)= 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com