
分析 (1)通過玻璃棒的攪拌可使混合物充分接觸而促進反應進行;燒杯和玻璃片之間的水結冰會將二者粘在一起;
(2)形成化學鍵釋放能量,燃燒放熱、有些化合反應是吸熱反應,如碳和二氧化碳反應制一氧化碳,大多數分解反應是吸熱反應,氧化反應、酸堿中和、炸藥爆炸是放熱反應;
(3)等質量的硫蒸氣具有的能量比硫固體多;
(4)依據中和熱的概念是強酸強堿的稀溶液完全反應生成1mol水放出的熱量分析;
(5)根據舊鍵斷裂吸收的能量減去新鍵生成釋放的能量值即為反應熱解答,燃燒反應為放熱反應.
解答 解:(1)固體參加的反應,攪拌可使混合物充分接觸而促進反應進行,通過玻璃片上結冰現象,可以知道氫氧化鋇晶體和氯化銨之間的反應是吸熱的,
故答案為:攪拌,使反應物充分接觸,促進反應;玻璃片上水結冰而與燒杯粘在一起;
(2)形成化學鍵、燃料的燃燒、葡萄糖在體內的氧化反應、酸堿中和反應和炸藥的爆炸過程都屬于放熱反應,而化合反應不一定為放熱反應,如二氧化碳與C的反應屬于吸熱反應,所以不一定釋放能量的為化合反應,
故答案為:C;
(3)等質量的硫蒸氣和硫固體相比較,硫蒸氣具有的能量多,因此完全燃燒硫蒸氣放出的熱量多,
故答案為:B;
(4)1mol H2SO4與NaOH溶液恰好完全反應時生成2molH2O,放出QkJ熱量,中和熱指生成1mol水放出的熱量,則H2SO4與NaOH反應則中和熱為:$\frac{Q}{2}$kJ/mol,
故答案為:$\frac{Q}{2}$;
(5)1molH2O中含2molH-O鍵,斷開1molH-H、1molO=O、1molO-H鍵需吸收的能量分別為Q1、Q2、Q3kJ,則成1molO-H鍵放出Q3kJ熱量,對于反應H2(g)+$\frac{1}{2}$O2(g)=H2O(g),斷開1 mol O=O鍵和1 molH-O鍵所吸收的能量Q1+$\frac{1}{2}$Q2,生成新鍵釋放的能量2Q3,該反應放熱,2Q3-(Q1+$\frac{1}{2}$Q2)>0,即2Q1+Q2<4Q3,
故答案為:C.
點評 本題考查了化學反應與能量變化,注意掌握中和熱的概念,(5)1molH2O中含2molH-O鍵為解答易錯點,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | ①⑥③②⑤④⑦ | B. | ①⑥④②⑤③⑦ | C. | ①⑥④⑤②③⑦ | D. | ①⑥③④⑤②⑦ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
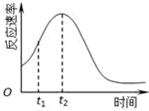 已知用硫酸酸化的草酸(H2C2O4)溶液能與KMnO4溶液反應.某化學小組研究發現,少量MnSO4可對該反應起催化作用.為進一步研究有關因素對該反應速率的影響,探究如下:
已知用硫酸酸化的草酸(H2C2O4)溶液能與KMnO4溶液反應.某化學小組研究發現,少量MnSO4可對該反應起催化作用.為進一步研究有關因素對該反應速率的影響,探究如下:| 實驗編號 | 溫度 | 初始pH | 0.1mol/L草酸溶液體積/mL | 0.01mol/LKMnO4 溶液體積/mL | 蒸餾水體積/mL | 待測數據(混合液褪色時間/s) |
| ① | 常溫 | 1 | 20 | 50 | 30 | t1 |
| ② | 常溫 | A | B | C | 30 | t2 |
| ③ | 常溫 | 2 | 40 | D | E | t3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
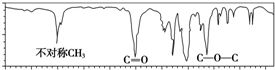
| A. | CH3COOCH2CH3 | B. | CH3CH2COOH | C. | HCOOCH2CH2CH3 | D. | (CH3)2CHCH2COOH |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 實驗操作 | 現象 | 解釋或結論 |
| A | 過量的Fe粉中加入稀HNO3,充分反應后,滴入KSCN溶液 | 溶液呈紅色 | 稀HNO3將Fe氧化為Fe3+ |
| B | 往待測液中滴加硝酸銀溶液 | 有白色沉淀出現 | 待測液中含有Cl- |
| C | Al箔插入稀HNO3中 | 無現象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
| D | 用玻璃棒蘸取濃氨水點到紅色石蕊試紙上 | 試紙變藍色 | 濃氨水呈堿性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CO2(SO2):飽和NaHCO3溶液 | B. | NO(NO2):水 | ||
| C. | Cl2(HCl):NaOH溶液 | D. | Na2CO3固體(NaHCO3):加熱 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com