
綠礬(FeSO4·7H2O)是治療缺鐵性貧血藥品的重要成分。下面是以市售鐵屑(含少量錫、氧化鐵等雜質)為原料生產純凈綠礬的一種方法: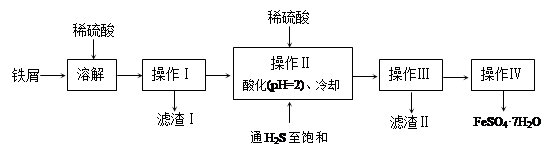
已知:室溫下飽和H2S溶液的pH約為3.9,SnS沉淀完全時溶液的pH為1.6;FeS開始沉淀時溶液的pH為3.0,沉淀完全時的pH為5.5。
(1)操作II中,通入硫化氫至飽和的目的是 _________________________ ;在溶液中用硫酸酸化至pH=2的目的是 _______________________________ 。
(2)檢驗制得的綠礬晶體中是否含有Fe3+的實驗操作是 。
(3)測定綠礬產品中Fe2+含量的方法是:
a.稱取3.7200g綠礬產品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待測溶液于錐形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至終點,消耗KMnO4溶液體積的平均值為20.00mL。
①已知KMnO4酸性溶液與Fe2+反應時被還原為Mn2+,請寫出該反應的離 ;
②在滴定實驗中不能選擇 式滴定管,理由是 ;
③計算上述樣品中FeSO4·7H2O的質量分數為 (用小數表示,保留兩位小數)。
(1)①除去溶液中的Sn2+,并防止亞鐵離子被氧化;防止亞鐵離子生成沉淀
(2)取少量晶體溶于水,滴加KSCN溶液,弱溶液不顯紅色,表明溶液不含有鐵離子。溶液顯紅色表明溶液中含有鐵離子(2分)
(3)①5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O(2分)
②堿(2分);高錳酸鉀是強氧化劑,它會腐蝕乳膠管(2分) ③0.75(3分)
解析試題分析:(1)①硫化氫具有強還原性,可以防止亞鐵離子被氧化。又因為室溫下飽和H2S溶液的pH約為3.9,而SnS沉淀完全時溶液的pH為1.6,所以操作II中,通入硫化氫至飽和的另一個目的是除去溶液中的Sn2+;由于FeS開始沉淀時溶液的pH為3.0,沉淀完全時的pH為5.5,因此操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是防止亞鐵離子生成沉淀。
(2)檢驗所得綠礬晶體中是否含有Fe3+的實驗操作是利用三價鐵離子與KSCN溶液發生顯色反應使溶液顯紅色進行判斷。即取少量晶體溶于水,滴加KSCN溶液,弱溶液不顯紅色,表明溶液不含有鐵離子。溶液顯紅色表明溶液中含有鐵離子。
(3)①高錳酸鉀溶液具有強氧化性,能氧化亞鐵離子。反應中Mn元素的化合價從+7價降低到+2價,得到2個電子。亞鐵離子在反應中失去1個電子,因此根據電子得失守恒可知,氧化劑高錳酸鉀與還原劑亞鐵離子的物質的量之比=1:5,所以反應的離子方程式為5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O。
②由于高錳酸鉀溶液具有強氧化性,能氧化橡膠管,從而腐蝕乳膠管,所以不能用堿式滴定管,應該用酸式滴定管。
③用硫酸酸化的0.01000mol/L KMnO4溶液滴定至終點,消耗KMnO4溶液體積的平均值為20.00mL,則消耗高錳酸鉀的物質的量=0.01000mol/L×0.0200L=0.0002mol
5Fe2++8H++MnO4-=5Fe3++Mn2++4H2O
5mo 1mol
n(Fe2+) 0.0002mol
計算得到n(Fe2+)=0.001mol
則250mL溶液中含n(Fe2+)=0.001mol×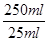 =0.01mol
=0.01mol
所以FeSO4?7H2O物質的量為0.01mol
質量=0.01mol×278g/mol=2.78g
則質量分數=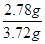 =0.75
=0.75
考點:考查硫酸亞鐵晶體制備實驗的方案設計與評價;氧化還原滴定的有關判斷與計算等


科目:高中化學 來源: 題型:實驗題
鋁元素在自然界中主要存在于鋁土礦(主要成分為Al2O3,還含有Fe2O3、FeO、SiO2)中。工業上用鋁土礦制備鋁的某種化合物的工藝流程如下。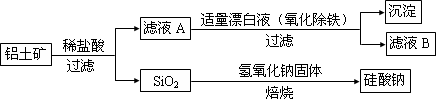
(1)在濾液A中加入漂白液,目的是氧化除鐵,所得濾液B顯酸性。
①檢驗濾液B中是否還含有鐵元素的方法為: (注明試劑、現象)。
②檢驗濾液A中是否含有Fe2+的試劑是 ,其實驗現象為 。
③由濾液B制備氯化鋁晶體涉及的操作為:邊滴加濃鹽酸邊蒸發濃縮、冷卻結晶、 (填操作名稱)、洗滌。
(2)SiO2和NaOH焙燒制備硅酸鈉,可采用的裝置為 (填代號)。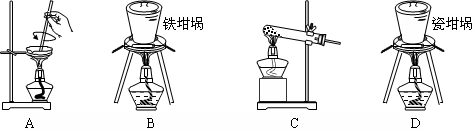
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
某氯化鐵樣品含有少量FeCl2雜質。現要測定其中鐵元素的質量分數,實驗按以下步驟進行:
請根據上面流程,回答以下問題:
(1)操作I是配制溶液,所用到的玻璃儀器除燒杯、玻璃棒外,還必須有 、 .(填儀器名稱)
(2)下列操作可能使所配溶液濃度偏小的是________________(填寫序號)。
①未洗滌燒杯和玻璃棒
②定容時俯視容量瓶的刻度線
③配溶液前容量瓶中有少量蒸餾水
④搖勻后,發現液面低于刻度線后繼續加水至凹液面與刻度線相切
(3)請寫出加入氯水發生的離子方程式 ,
(4)檢驗沉淀是否已經洗滌干凈的操作是 。
(5)若原樣品質量a為50g,加熱后紅棕色固體質量b為3g,則樣品中鐵元素的質量分數是 。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
紅熱的鐵能與水蒸氣反應,有氫氣生成,現用如圖所示裝置進行鐵在高溫下與水蒸氣反應的實驗,并用簡單的方法收集、檢驗生成的氫氣。請回答下列問題:
(1)寫出鐵在高溫下與水蒸氣反應的化學方程式: 。
(2)干燥管C內盛放的藥品是 和 (填化學式)。干燥管的 (填“m”或“n”)端與g導管相連接。
(3)在D處畫出用試管收集氫氣的裝置圖(所需其他儀器自行選擇)。
(4)怎樣用簡單的方法檢驗收集到的氣體是氫氣,簡述實驗操作步驟和現象 。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
為測定Na2CO3和NaHCO3固體混合物中Na2CO3的質量分數,稱取一定質量的樣品,甲同學利用圖I所示裝置測量產生CO2的體積,乙同學利用圖II所示裝置通過干燥管的增重測量產生CO2的質量,已知所用稀硫酸均足量。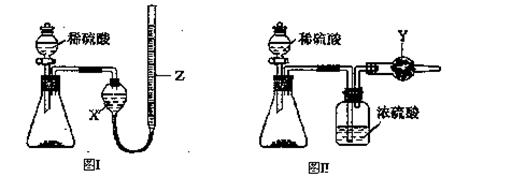
(l)盛放稀硫酸的儀器名稱為 。
(2)試劑X為 ;試劑Y為 。
(3)甲同學在進行實驗時,為減小誤差,應注意的事項有(填選項字母) 。
A.讀數前應使整套裝置冷卻至室溫
B.調整Z的高度使量氣裝置左右液面相平
C.讀數時視線與Z內凹液面最低點相切
D.讀數前應通入一定量的N2使生成的CO2全部進入量氣裝置
(4)按乙同學的實驗方案進行實驗,使測得的Na2CO3的質量分數偏高的因素有(寫一種)
,使測得的Na2CO3的質量分數偏低的因素有
(寫一種) 。
(5)為完成相同的測定任務,下列實驗方案不能達到實驗目的的是 (填選項字母)。
A.取mg混合物與足量Ba(OH)2溶液充分反應,過濾、洗滌、烘干得ng固體
B.取mg混合物與足量鹽酸充分反應,將溶液加熱、蒸干、灼燒得ng固體
C.取mg混合物充分加熱,固體質量減少ng
D.將圖II裝置中的稀硫酸改為稀鹽酸進行實驗
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
鐵礦石是工業煉鐵的主要原料之一,其主要成分為鐵的氧化物(設雜質中不含鐵元素和氧元素,且雜質不與H2SO4反應)。某研究性學習小組對某鐵礦石中鐵的氧化物的化學式進行探究。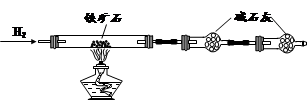
A B C
Ⅰ.鐵礦石中含氧量的測定
① 按上圖組裝儀器,檢查裝置的氣密性;
② 將5.0g鐵礦石放入硬質玻璃管中,裝置B、C中的藥品如圖所示(夾持儀器均省略);
③ 從左端導氣管口處不斷地緩緩通入H2,待C裝置出口處H2驗純后,點燃A處酒精燈
④ 充分反應后,撤掉酒精燈,再持續通入氫氣至完全冷卻。
(1)裝置C的作用為 。
(2)測的反應后裝置B增重1.35g,則鐵礦石中氧的百分含量為 。
Ⅱ.鐵礦石中含鐵量的測定
(1)步驟④中煮沸的作用是 。
(2)步驟⑤中用到的玻璃儀器有燒杯、玻璃棒、膠頭滴管、 。
(3)下列有關步驟⑥的操作中說法正確的是 。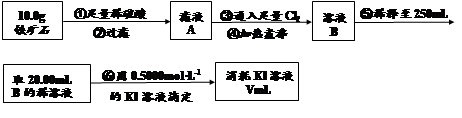
a.因為碘水為黃色,所以滴定過程中不需加指示劑
b.滴定過程中可利用淀粉溶液作為指示劑
c.滴定管用蒸餾水洗滌后可以直接裝液
d.錐形瓶不需要用待測液潤洗
e.滴定過程中,眼睛注視滴定管中液面變化
f.滴定結束后,30s內溶液不恢復原來的顏色再讀數
(4)若滴定過程中消耗0.5000mol·L?1KI溶液20.00mL,則鐵礦石中鐵的百分含量為 。
Ⅲ.由Ⅰ、Ⅱ可以推算出該鐵礦石中鐵的氧化物的化學式為 。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
電子工業常用30﹪的FeCl3溶液腐蝕敷在絕緣板上的銅箔,制造印刷電路板。廢腐蝕液含有大量CuCl2、FeCl2和FeCl3,任意排放將導致環境污染及資源的浪費,應考慮回收利用。按如下流程在實驗室進行實驗:從廢液中回收銅,并將鐵的化合物全部轉化為FeCl3溶液,作為腐蝕液原料循環使用。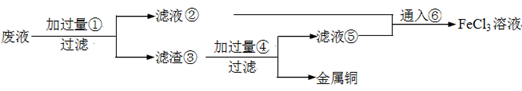
(1)寫出FeCl3溶液與銅箔發生反應的化學方程式: 。
(2)檢驗廢腐蝕液中含有Fe3+的實驗操作是
(3)“過濾”用到的玻璃儀器有:普通漏斗、 。
(4)廢液中加入過量①后,發生反應的離子方程式:
(5)上述流程中取廢液200 mL,其中含CuCl2 1.5 mol·L—1、FeCl2 3.0 mol·L—1、FeCl3 1.0 mol·L—1,若要將銅全部回收,需加入Fe粉的質量應不少于_____________g;將鐵的化合物全部轉化為FeCl3溶液需通入Cl2的物質的量不少于_______________mol。
(6)某化學興趣小組利用在下圖裝置制取氯氣并通入到FeCl2溶液中獲得FeCl3溶液。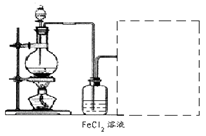
制備Cl2的化學方程式為:
該裝置不完整,請在所給虛線框內畫出所缺部分,并標注試劑。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
(1)實驗室用二氧化錳跟濃鹽酸反應制取氯氣的離子方程式為 。
(2)高錳酸鉀是常用氧化劑,在酸性條件下,MnO4-被還原成Mn2+,用高錳酸鉀跟濃鹽酸反應在室溫下制氯氣的離子方程式為 。
(3)歷史上曾用“地康法”制氯氣,這一方法是用CuCl2作催化劑,在450℃利用空氣中的氧氣跟氯化氫反應制氯氣,反應的化學方程式為 。
(4)現有100 mL AlCl3與MgSO4的混合溶液,分成兩等份。
① 向其中一份中加入10 mL 4 mol/L的氨水,恰好完全沉淀,其中AlCl3與氨水反應的離子方程式是 。繼續加入1 mol/L NaOH溶液至10 mL時,沉淀不再減少,沉淀減少的離子方程式是 ,減少的沉淀的物質的量是 。
② 向另一份中加入a mL 1 mol/LBaCl2溶液能使SO42-沉淀完全,a= 。
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列變化中,不屬于化學變化的是( )
| A.SO2使品紅溶液褪色 | B.氯氣使濕潤的紅色布條褪色 |
| C.活性碳使紅墨水褪色 | D.“84”消毒液使某些染料褪色 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com