
【題目】碳酸亞乙酯是一種重要的添加劑,其結構簡式為![]() 。用環氧乙烷合成碳酸亞乙酯的反應為:
。用環氧乙烷合成碳酸亞乙酯的反應為:![]() 。下列說法錯誤的是
。下列說法錯誤的是
A.上述反應屬于加成反應
B.碳酸亞乙酯的二氯代物只有兩種
C.碳酸亞乙酯中的所有原子處于同一平面內
D.1mol碳酸亞乙酯最多可消耗2molNaOH
科目:高中化學 來源: 題型:
【題目】已知:pKa=-lgKa,25℃時,H2SO3的pKa1=1.85,pKa2=7.19。用0.1 mol·L-1NaOH溶液滴定20mL 0.1mol·L-1H2SO3溶液的滴定曲線如下圖所示(曲線上的數字為pH)。下列說法正確的是
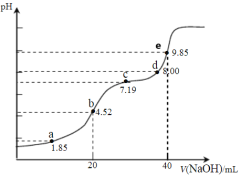
A.b點所得溶液中:c(H+)+c(SO32-)=c(OH-)+c(H2SO3)
B.a點所得溶液中:2c(HSO3-)+c(SO32-)=0.1mol·L-1
C.e點所得溶液中:c(Na+)> c(SO32-)> c(H+)> c(OH-)
D.c點所得溶液中:c(Na+)>3c(HSO3-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氯化二硫(S2Cl2)是廣泛用于橡膠工業的硫化劑;其分子結構中每個原子均滿足8電子結構。常溫下,S2Cl2是一種橙黃色的液體,遇水易水解,并產生能使品紅褪色的氣體。下列說法中錯誤的是( )
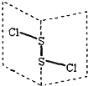
A. S2Cl2中的硫元素顯+1價
B. S2Cl2中含極性鍵和非極性鍵,是非極性分子
C. S2Br2與S2Cl2結構相似,熔沸點:S2Br2>S2Cl2
D. S2Cl2與H2O反應的生成物中可能有S
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Q、R、X、Y、Z五種元素的原子序數依次遞增。
已知:①Z的原子序數為29,其余的均為短周期主族元素;
②Y原子價電子(外圍電子)排布為msnmpn;
③Q、X原子p能級的電子數分別為2和4。請回答下列問題:
(1)Z2+的核外電子排布式是___;基態Q原子的價電子排布圖為_____。
(2)Q與Y形成的最簡單氣態氫化物分別為甲、乙,下列判斷正確的是____(填字母)。
a.穩定性:甲>乙 b.沸點:甲<乙
(3)Q、R、X三種元素的第一電離能數值由小至大的順序為_____(用元素符號作答)。
(4)五種元素中,電負性最大的非金屬元素是___,電負性最小的非金屬元素是___。(用元素符號作答)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定量的某磁黃鐵礦(主要成分FexS,S為-2價)與100mL鹽酸恰好完全反應(礦石中其他成分不與鹽酸反應),生成3.2g硫單質、0.4molFeCl2和一定量H2S氣體,且溶液中無Fe3+。則下列說法正確的是( )
A.該鹽酸的物質的量濃度為4.0mol·L-1
B.該磁黃鐵礦FexS中,Fe2+與Fe3+的物質的量之比為2:1
C.生成的H2S氣體在標準狀況下的體積為8.96L
D.該磁黃鐵礦中FexS的x=0.85
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】425℃時,在兩個1L密閉容器中分別發生化學反應,物質的濃度隨時間的變化如圖所示。下列敘述錯誤的是( )
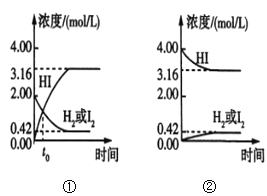
A.圖①中t0時,三種物質的物質的量相等
B.圖①中t0時,反應未達到平衡狀態
C.圖①②中,當c(HI)=3.16mol/L時,兩容器中的反應均達到平衡狀態
D.混合氣體的密度不再發生變化可以作為達到平衡狀態的標志
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有以下一系列反應,最終產物是乙二酸。
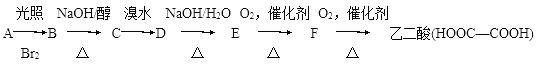
試回答下列問題:
(1)C的結構簡式是________。B―→C的反應類型是________。
(2)E―→F的化學方程式是__________
(3)E與乙二酸發生酯化反應生成環狀化合物的化學方程式是___________。
(4)由B發生水解反應或C與H2O發生加成反應均生成化合物G。在乙二酸、水、苯酚、G四種分子中,羥基上氫原子的活潑性由強到弱的順序是_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物A、B、C、D和E的結構簡式如下:
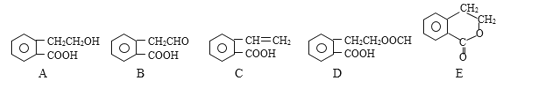
請回答下列問題:
(1)指出反應的類型:A→B_______;A→D_______。
(2)在A~E五種物質中,互為同分異構體的是_______;所有的原子有可能都在同一平面的物質是_______。(填序號)
(3)寫出由A生成C的化學方程式:_______。
(4)寫出D與NaOH溶液共熱反應的化學方程式:_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是制備和收集氣體的實驗裝置,該裝置不能用于( )
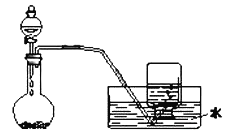
A.Zn與稀硫酸制H2B.稀硝酸與銅反應制取一氧化氮
C.雙氧水制取氧氣D.用Cu和濃硫酸制取SO2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com