
【題目】加熱蒸干氯化鎂溶液時因水解不完全會得到一種灰白色沉淀——堿式氯化鎂,化學式可表示為Mgx(OH)yClz·nH2O,設計如圖裝置驗證其化學式。下列有關實驗的說法不正確的是( )
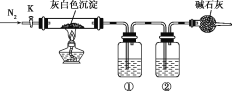
A.堿式氯化鎂受熱分解可以生成氧化鎂、氯氣和水
B.結束反應時,先停止加熱,通一段時間N2后再關閉活塞K
C.①②中依次盛裝濃硫酸、氫氧化鈉溶液
D.只需稱量原樣品質量、反應結束后硬質玻璃管中剩余固體質量以及裝置①增重的質量即可推出其化學式
 金牌教輔培優優選卷期末沖刺100分系列答案
金牌教輔培優優選卷期末沖刺100分系列答案科目:高中化學 來源: 題型:
【題目】1mol白磷(P4,s)和4mol紅磷(P,s)與氧氣反應過程中的能量變化如圖(E表示能量)。下列說法正確的是( )
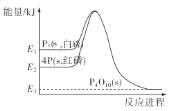
A. P4(s,白磷)=4P(s,紅磷) ΔH>0
B. 以上變化中,白磷和紅磷所需活化能相等
C. 白磷比紅磷穩定
D. 紅磷燃燒的熱化學方程式是4P(s,紅磷)+5O2(g)=P4O10(s) ΔH=-(E2-E3)kJ/mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗操作能達到實驗目的的是

A. 用經水濕潤的pH試紙測量溶液的pH
B. 將4.0 g NaOH固體置于100 mL容量瓶中,加水至刻度,配制1.000 mol·L1NaOH溶液
C. 用裝置甲蒸干AlCl3溶液制無水AlCl3固體
D. 用裝置乙除去實驗室所制乙烯中的少量SO2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知銅和濃硫酸可以在加熱條件下發生如下反應(反應方程式已配平):Cu+2H2SO4(濃) ![]() CuSO4+X↑+2H2O試通過計算和推理回答下面的問題:
CuSO4+X↑+2H2O試通過計算和推理回答下面的問題:
(1)X物質可以導致酸雨的形成,X應該屬于________(填字母代號)。
a.酸 b.堿 c.鹽 d.酸性氧化物 e.堿性氧化物
(2)X物質可以使酸性KMnO4溶液褪色,該過程中(填化學式,下同)______失去電子,氧化劑是______。
(3)足量的銅片與20mL18mol·L-1的濃H2SO4充分反應,如果該反應過程中轉移了0.2mol電子,生成的CuSO4的物質的量為______mol,生成的X氣體在標準狀況下體積為______L(假設氣體全部逸出)。
(4)將(3)反應后得到的溶液與過量Ba(OH)2溶液混合,充分反應,反應后所得沉淀的質量為______g。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵被譽為“第一金屬”,鐵及其化合物在生活中有廣泛應用
(1)基態Fe3+的電子排布式為________。
(2)實驗室用KSCN溶液、苯酚(![]() )檢驗Fe3+。N、O、S的第一電離能由大到小的順序為_______(用元素符號表示),苯酚中碳原子的雜化軌道類型為______。
)檢驗Fe3+。N、O、S的第一電離能由大到小的順序為_______(用元素符號表示),苯酚中碳原子的雜化軌道類型為______。
(3)FeCl3的熔點為306℃,沸點為315℃ FeCl3的晶體類型是______。FeSO4常作補鐵劑,SO42-的立體構型是_______。
(4)基鐵[Fe(CO)5]可用作催化劑、汽油抗爆劑等,1 mol Fe(CO)5分子中含σ鍵數目為_______,與CO互為等電子體的離子是__________(填化學式,寫一種)
(5)氮化鐵晶體的晶體結構示意圖如圖1所示。該晶體中鐵、氮的微粒個數之比為______。
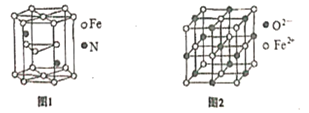
(6)氧化亞鐵晶體的晶胞如圖2所示。已知:氧化亞鐵晶體的密度為ρg·cm-1,NA代表阿伏加德羅常數的值。在該晶胞中,與Fe2+緊鄰且等距離的Fe2+數目為_____;Fe2+與O2-的最短間距為_______ pm。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】美國斯坦福大學的工程師設計出一種從污水“提取”潛在電能的新型微生物電池,該電池能將生活污水中的有機物分解同時發電,電池結構如圖所示。已知a電極為惰性材料,b電極為Ag2O。下列說法不正確的是( )
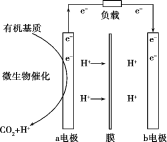
A.a電極是負極,b電極是正極
B.b電極發生的反應是Ag2O+2e-+2H+=2Ag+H2O
C.a電極每生成標準狀況下2.24LCO2,可向b電極轉移0.1mol電子
D.高溫條件下,該電池不能正常工作
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)t1℃時,密閉容器中,通入一定量的CO和H2O,發生如下反應:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0。容器中各物質濃度(單位:mol·L-1)變化如下表所示:
CO2(g)+H2(g) ΔH<0。容器中各物質濃度(單位:mol·L-1)變化如下表所示:
時間(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
①一定處于平衡狀態的時間段為___。
②5~6min時間段內,平衡移動方向為___(填“向左移動”或“向右移動”),根據表中數據判斷,平衡移動的原因是___(填字母編號)。
a.增加了H2O(g)的量 b.增加氫氣濃度
c.使用催化劑 d.降低溫度
③t2℃時(t2>t1),在相同條件下發生上述反應,達平衡時,CO濃度___c1(填“>”“<”或“=”)。
(2)已知反應Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常數隨溫度變化情況如圖1所示:
FeO(s)+CO(g)的平衡常數隨溫度變化情況如圖1所示:

①用CO還原FeO制備Fe的反應是___(填“吸熱”或“放熱”)反應。
②溫度為T2時,實驗測得該反應體系中CO濃度為CO2的2.5倍,則T2___T1(填“>”“<”或“=”)。
(3)工業上常用CO、CO2和H2合成甲醇燃料,其原理為:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
②CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH>0
CO(g)+H2O(g) ΔH>0
當混合氣體的組成固定時,CO平衡轉化率(α)與溫度和壓強的關系如圖2所示。
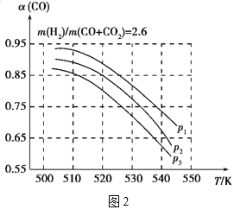
圖中的壓強由大到小的順序為___,判斷理由是___;試解釋CO平衡轉化率隨溫度升高而減小的原因是___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】![]() 是火箭的固體燃料,發生反應為
是火箭的固體燃料,發生反應為![]() ,下列說法正確的是( )
,下列說法正確的是( )
A.![]() 溶于水電離方程式為
溶于水電離方程式為![]()
B.反應中還原產物分子數與氧化產物分子總數之比為1∶3
C.產生![]() 反應轉移的電子總數為
反應轉移的電子總數為![]()
D.![]() 分解產生的氣體體積為44.8L
分解產生的氣體體積為44.8L
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com