
分析 水溶液中或熔融狀態下能夠導電的化合物稱為電解質,包括酸、堿、鹽都是電解質;
可溶性電解質和能夠與水反應生成可溶性電解質的物質,溶于水后能夠導電.
解答 解:①NaCl晶體溶于水或者熔化時能電離出自由離子而導電,屬于電解質;水溶液能導電;
②液態SO3本身不能電離,不是電解質;SO3與水反應生成硫酸是可溶性的電解質,水溶液導電;
③液態的醋酸溶于水時能電離出自由離子而導電,屬于電解質;水溶液能導電;
④汞是金屬單質,不是電解質,不溶于水;水溶液能導電;
⑤BaSO4固體熔化時能電離出自由離子而導電,屬于電解質;難溶于水,水溶液不導電;
⑥純蔗糖(C12H22O11)本身不能電離,是非電解質;水溶液不導電;
⑦酒精(C2H5OH)溶于水和熔化時都不導電,不是電解質;水溶液不導電;
⑧熔化的KNO3溶于水或者熔化時能電離出自由離子而導電,屬于電解質;水溶液能導電;
(1)以上物質中屬于電解質的是 ①③⑤⑧;故答案為:①③⑤⑧;
(2)以上物質中溶于水后形成的水溶液能導電的是 ①②③⑧,故答案為:①②③⑧.
點評 本題考查了電解質的判斷,判斷電解質時應注意抓住概念的內涵,電解質必須是化合物,必須本身能電離.


 教學練新同步練習系列答案
教學練新同步練習系列答案 課前課后同步練習系列答案
課前課后同步練習系列答案 課堂小作業系列答案
課堂小作業系列答案 黃岡小狀元口算速算練習冊系列答案
黃岡小狀元口算速算練習冊系列答案 成功訓練計劃系列答案
成功訓練計劃系列答案 倍速訓練法直通中考考點系列答案
倍速訓練法直通中考考點系列答案科目:高中化學 來源: 題型:選擇題
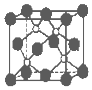 磷化硼是一種超硬耐磨涂層材料.如圖為其晶體結構中最小的重復結構單元,其中的每個原子均滿足8電子穩定結構.下列有關說法正確的是( )
磷化硼是一種超硬耐磨涂層材料.如圖為其晶體結構中最小的重復結構單元,其中的每個原子均滿足8電子穩定結構.下列有關說法正確的是( )| A. | 磷化硼晶體的化學式為BP,屬于離子晶體 | |
| B. | 磷化硼晶體的熔點高,且熔融狀態下能導電 | |
| C. | 磷化硼晶體結構微粒的空間堆積方式與氯化鈉相同 | |
| D. | 磷化硼晶體中每個原子均形成4個共價鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
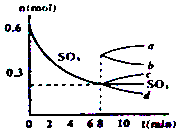 在一個2L的密閉容器中,發生反應2SO3(g)?2SO2(g)+O2(g);△H>0,其中SO3的變化如圖所示:
在一個2L的密閉容器中,發生反應2SO3(g)?2SO2(g)+O2(g);△H>0,其中SO3的變化如圖所示:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na+、CO32- | B. | Na+、HCO3- | C. | CO32-、HCO3- | D. | Na+、OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 二氧化氯具有還原性,可用于自來水的殺菌消毒 | |
| B. | 液氨汽化時要吸收大量的熱,可用作制冷劑 | |
| C. | 硫具有還原性,可用硫粉覆蓋地上灑落的汞 | |
| D. | 硅是重要的半導體材料,常用于制作光導纖維 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH3-CH═CH-CHO | B. |  | ||
| C. | HOCH2-CH2-CH═CH-CHO | D. |  |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

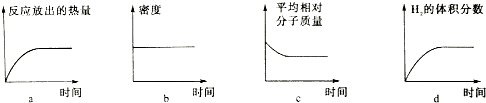
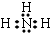 .
.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com