
| A. | 溶液中水電離出的c(H+)=10-3mol/L | |
| B. | 溶液中c(A-)=10-3mol/L | |
| C. | 溶液中加水稀釋,促進HA電離,溶液的c(H+)增大,但k不變 | |
| D. | 與0.1mol/LNaOH溶液等體積混合后所得溶液中(體積變化忽略不計)c(Na+)═c(A-)+c(OH-)-c(H+)=0.1 mol/L |
分析 常溫下0.1mol/L某一元酸(HA)溶液中c(H+)=1×10-3,說明HA為弱酸,在溶液中存在電離平衡,
A.酸電離出的氫離子抑制了水的電離,溶液中氫氧根離子是水電離的,結合水的離子積計算水電離的氫離子濃度;
B.溶液中氫氧根離子濃度較小,根據電荷守恒計算;
C.稀釋HA溶液后HA的電離程度增大,但溶液中氫離子濃度減小;
D.兩溶液恰好反應生成NaA,根據電荷守恒判斷.
解答 解:常溫下0.1mol/L某一元酸(HA)溶液中c(H+)=1×10-3,說明HA為弱酸,在溶液中存在電離平衡,
A.酸電離出的氫離子抑制了水的電離,溶液中氫氧根離子是水電離的,則水電離的氫離子濃度為:c(H+)=10-11mol/L,故A錯誤;
B.根據電荷守恒可知c(A-)=c(H+)-c(OH-)≈10-3mol/L,故B正確;
C.稀釋HA溶液后,HA的電離程度增大,電離平衡常數K不變,但溶液中氫離子濃度減小,故C錯誤;
D.與0.1mol/LNaOH溶液等體積混合后恰好反應生成NaA,根據電荷守恒可知所得溶液中(體積變化忽略不計)c(Na+)═c(A-)+c(OH-)-c(H+)=0.05 mol/L,故D錯誤;
故選B.
點評 本題考查了弱電解質的電離平衡及其影響,題目難度中等,明確弱電解質電離平衡及其影響為解答關鍵,注意掌握電荷守恒、物料守恒的含義及應用方法,試題培養了學生的分析能力及靈活應用能力.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
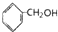
| A. | ①③ | B. | ①④⑤ | C. | ②④ | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.4 mol•(L•s)-1 | B. | 0.3 mol•(L•s)-1 | C. | 0.2 mol•(L•s)-1 | D. | 0.1 mol•(L•s)-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題


查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子序數B>A>C | B. | 原子半徑A>B>C | ||
| C. | 離子半徑A2->B2+>C- | D. | 原子最外層電子數C>A>B |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
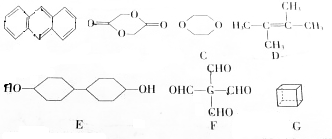
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 膠體比溶液更穩定 | |
| B. | 從外觀一定能區別溶液和膠體 | |
| C. | 用滲析的方法凈化膠體時,使用的半透膜只能讓離子、小分子通過 | |
| D. | 淀粉溶液不是膠體 |
查看答案和解析>>
科目:高中化學 來源:2017屆河南省高三上第二次月考化學試卷(解析版) 題型:選擇題
已知甲、乙、丙、丁是中學化學常見的物質,一定條件下可發生如下轉化: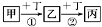 ,下列相關離子方程式或化學方程式錯誤的是
,下列相關離子方程式或化學方程式錯誤的是
A. ①可能為AlO2-+H++H2O=Al(OH)3↓
B. ①可能為Fe+2Fe3+=3Fe2+
C. ②可能為2NO+O2=2NO2
D. ②可能為Na2CO3+H2O+CO2=2NaHCO3
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com