
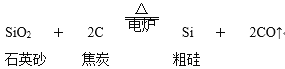
【題目】從硅的氧化物可以制取硅單質,主要化學反應如下:粗硅的制取:
由粗硅制純硅(常用方法):Si(粗)+2Cl2![]() SiCl4 SiCl4+2H2
SiCl4 SiCl4+2H2![]() Si(純)+4HCl
Si(純)+4HCl
根據以上反應,回答下列問題。
(1)在制取粗硅的反應中,焦炭的作用是什么___?
(2)在由粗硅制純硅的反應中,氯氣(Cl2)與Si的反應屬于什么類型的反應___?SiCl4與H2的反應屬于什么類型的反應___?H2的作用是什么___?
(3)在半導體工業中有這樣一句行話:“從沙灘到用戶”,你是如何理解的___?
【答案】還原劑 化合反應 置換反應 還原劑 利用沙灘中的SiO2制成用戶中需要的光導纖維(SiO2),半導體材料(Si)
【解析】
(1)根據反應中元素化合價變化判斷C的作用;
(2)根據反應方程式及四種基本反應類型的概念判斷其反應類型;根據元素化合價變化判斷氫氣的作用;
(3)從沙灘到用戶,經歷了硅的冶煉和提純。
(1)粗硅的制取:SiO2(石英砂)+2C(焦炭)![]() Si(粗)+2CO↑中,C化合價從0變為+2,化合價升高被氧化,為還原劑,
Si(粗)+2CO↑中,C化合價從0變為+2,化合價升高被氧化,為還原劑,
故答案為:還原劑;
(2)Cl2與Si反應生成四氯化硅,該反應屬于化合反應;SiCl4與H2反應生成硅單質和氯化氫,該反應屬于置換反應,該反應中氫氣化合價升高被氧化,為還原劑,
故答案為:化合反應;置換反應;還原劑;
(3)從沙灘到用戶,經歷了硅的冶煉和提純,硅的冶煉的化學方程式:SiO2 +2C=Si+2CO↑,硅的提純的化學方程式:Si(粗)+2Cl2=SiCl4 ,SiCl4+2H2=Si(純)+4HCl,故答案為:從沙灘到用戶,經歷了硅的冶煉和提純,利用沙灘中的SiO2制成用戶中需要的光導纖維(SiO2),半導體材料(Si)。


 小學教材全測系列答案
小學教材全測系列答案科目:高中化學 來源: 題型:
【題目】天然氣的主要成分為CH4,一般還含有C2H6等烴類,是重要的燃料和化工原料。
(1)乙烷在一定條件可發生如下反應:C2H6(g)= C2H4(g)+H2(g) ΔH,相關物質的燃燒熱數據如下表所示:
物質 | C2H6(g) | C2H4(g) | H2(g) |
燃燒熱ΔH/( kJ·mol1) | -1560 | -1411 | -286 |
①ΔH=_________kJ·mol1。
②提高該反應平衡轉化率的方法有_________、_________。
③容器中通入等物質的量的乙烷和氫氣,在等壓下(p)發生上述反應,乙烷的平衡轉化率為α。反應的平衡常數Kp=_________(用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)。
(2)高溫下,甲烷生成乙烷的反應如下:2CH4![]() C2H6+H2。反應在初期階段的速率方程為:r=k×
C2H6+H2。反應在初期階段的速率方程為:r=k×![]() ,其中k為反應速率常數。
,其中k為反應速率常數。
①設反應開始時的反應速率為r1,甲烷的轉化率為α時的反應速率為r2,則r2=_____ r1。
②對于處于初期階段的該反應,下列說法正確的是_________。
A.增加甲烷濃度,r增大 B.增加H2濃度,r增大
C.乙烷的生成速率逐漸增大 D.降低反應溫度,k減小
(3)CH4和CO2都是比較穩定的分子,科學家利用電化學裝置實現兩種分子的耦合轉化,其原理如下圖所示:
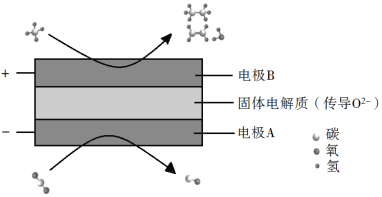
①陰極上的反應式為_________。
②若生成的乙烯和乙烷的體積比為2∶1,則消耗的CH4和CO2體積比為_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.1mol有機物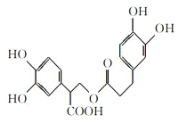 在一定條件下能和7molNaOH反應
在一定條件下能和7molNaOH反應
B.![]() 所有碳原子可能都在同一平面上
所有碳原子可能都在同一平面上
C.分子式為C4H7ClO2,可與NaHCO3產生CO2的有機物的結構有3種
D.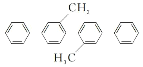 的一氯代物有9種(不考慮立體異構)
的一氯代物有9種(不考慮立體異構)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯可形成多種含氧酸鹽,廣泛應用于殺菌、消毒及化工領域。實驗室中利用下圖裝置(部分裝置省略)制備KClO3和NaClO,探究其氧化還原性質。
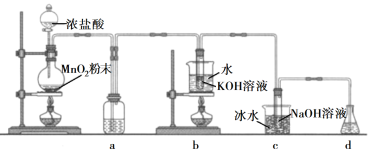
回答下列問題:
(1)盛放MnO2粉末的儀器名稱是________,a中的試劑為________。
(2)b中采用的加熱方式是_________,c中化學反應的離子方程式是________________,采用冰水浴冷卻的目的是____________。
(3)d的作用是________,可選用試劑________(填標號)。
A.Na2S B.NaCl C.Ca(OH)2 D.H2SO4
(4)反應結束后,取出b中試管,經冷卻結晶,________,__________,干燥,得到KClO3晶體。
(5)取少量KClO3和NaClO溶液分別置于1號和2號試管中,滴加中性KI溶液。1號試管溶液顏色不變。2號試管溶液變為棕色,加入CCl4振蕩,靜置后CCl4層顯____色。可知該條件下KClO3的氧化能力____NaClO(填“大于”或“小于")。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銅轉爐煙灰主要含有Zn[還有少量的Fe(+2價)、Pb、Cu、As等元素]的硫酸鹽和氧化物,少量為砷酸鹽。制備重要化工原料活性氧化鋅的工藝流程如圖所示。請回答以下問題:
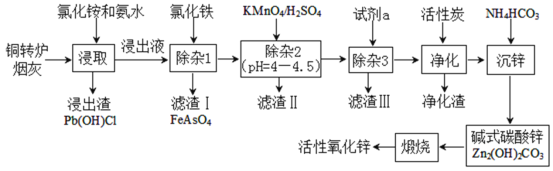
己知:活性炭凈化主要是除去有機雜質。
(1)寫出氯化銨的電子式___,“凈化”過程屬于___(填“物理”、“化學”)變化。
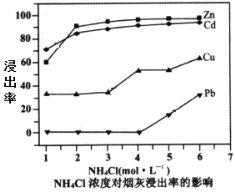
(2)在反應溫度為50℃,反應時間為1h時,測定各元素的浸出率與氯化銨溶液濃度的關系如圖,則氯化銨適宜的濃度為___mol·L-1。若浸出液中鋅元素以[Zn(NH3)4]2+形式存在,則浸取時ZnO發生反應的離子方程式為___。
(3)滴加KMnO4溶液有MnO2生成,目的是除___元素,除雜3是置換除雜過程,則試劑a是___,“濾渣Ⅲ”的主要成分為___(填化學式)。
(4)寫出“沉鋅”時發生反應的離子方程式___,此過程中可以循環利用的副產品是___。
(5)取mg活性氧化鋅樣品配成待測液,加入指示劑3、4滴,再加入適量六亞甲基四胺,用amolL-1EDTA標準液進行滴定,消耗標準液VmL。己知:與1.0mLEDTA標準液[c(EDTA)=1.000mo1L-1]相當的以克表示的氧化鋅質量為0.08139,則樣品中氧化鋅的質量分數為___(用代數式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有關下列三個反應的敘述,正確的是( )
①2H2S+SO2=3S↓+2H2O
②S+2H2SO4(濃)![]() 3SO2↑+2H2O
3SO2↑+2H2O
③3S+6KOH![]() 2K2S+K2SO3+3H2O
2K2S+K2SO3+3H2O
A.反應①說明SO2能與酸反應,具有堿性氧化物的性質
B.反應②改用稀H2SO4,則能放出氫氣
C.反應②和③說明S具有兩性元素的性質
D.反應③說明S既具有氧化性又具有還原性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】寫出下對反應的化學方程式,并注明反應類型:
(1)乙醇制乙烯:__,反應類型:__。
(2)乙醇與濃氫溴酸反應:__,反應類型__。
(3)苯酚與濃溴水反應:__,反應類型__。
(4)乙醛與新制氫氧化銅懸濁液反應:__,反應類型__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將32.64g銅與140mL一定濃度的硝酸反應,銅完全溶解產生的NO和NO2混合氣體在標準狀況下的體積為11.2L。請回答:
(1)NO的體積為________L,NO2的體積為________L。
(2)待產生的氣體全部釋放后,向溶液中加入VmLamol/L的NaOH溶液,恰好使溶液中Cu2+全部轉化成沉淀,則原硝酸溶液的濃度為__________mol/L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2019年12月4日“全球碳計劃”發布報告說,全球CO2排放量增速趨緩。人們還需要更有力的政策來逐步淘汰化石燃料的使用。CO2的綜合利用是解決溫室問題的有效途徑。
(1)一種途徑是用CO2轉化為成為有機物實現碳循環。如:
C2H4(g)+H2O(l)C2H5OH(l) ΔH=-44.2kJ·mol-1;
2CO2(g)+2H2O(l)C2H4(g)+3O2(g) ΔH=+1411.0kJ·mol-1。
已知2CO2(g)+3H2O(l)C2H5OH(l)+3O2(g),其正反應的活化能為Ea kJ·mol1,則逆反應的活化能為__kJ·mol-1。乙烯與HCl加成生成的氯乙烷在堿性條件下水解也得到乙醇,其水解反應的離子方程式為__,v=kcm(CH3CH2Cl)cn(OH-)為速率方程,研究表明,CH3CH2Cl濃度減半,反應速率減半,而OH-濃度減半對反應速率沒有影響,則反應速率方程式為__。
(2)利用工業廢氣中的CO2可以制取甲醇和水蒸氣,一定條件下,往2L恒容密閉容器中充入1mol CO2和3mol H2,在三種不同催化劑作用下發生反應,相同時間內CO2的轉化率隨溫度變化曲線如圖所示:
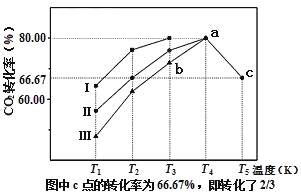
①催化劑效果最佳的反應是__(填“曲線I”,“曲線II”,“曲線III”)。
②b點,υ(正)__υ(逆)(填“>”,“<”,“=”)。
③若此反應在a點時已達平衡狀態,a點的轉化率比c點高的原因是__。
④c點時該反應的平衡常數K=__。
(3)中國科學家首次用CO2高效合成乙酸,其反應路徑如圖所示:
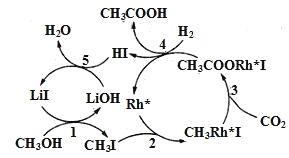
①根據圖示,寫出總反應的化學方程式:__。
②原料中的CH3OH可通過電解法由CO2制取,用稀硫酸作電解質溶液,寫出生成CH3OH的電極反應式__。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com