
在A、B、C、D、E五種短周期主族元素中,A、B、C三種元素的原子序數依次增大,A、C都能與B按原子個數比為1:1或2:1形成的化合物。D的原子最外層電子數最多,E的核電荷數最大,D與E能形成氣態物質ED4。
(1)畫出D的原子結構示意圖________,五種元素原子半徑從大到小的順序是________(填元素符號)。
(2)A與B形成的化合物中,含非極性鍵的化合物的結構式為 。
(3)C與B按原子個數比為1:1形成化合物的電子式是 。
(4)D、E所形成氫化物的穩定性由強到弱的順序是 、 (填具體的化學式)。
(5)由短周期元素組成的某些微粒,如SO2、O3、NO2-可互稱為等電子體,則與B、D同周期元素組成的微粒中,能與N3-.CS2互稱為等電子體的微粒是 (填符合要求所有微粒的名稱)。
(6)寫出工業上制E單質的化學方程式 。
(15分,每空2分)答案:(1) Na、Si、O、F、H
Na、Si、O、F、H
(2)H—O—O—H (3)
(4)HF、SiH4 (5)二氧化碳、一氧化二氮、二氟化鈹(3分)
(6)2C+SiO2 Si+2CO↑
Si+2CO↑
解析試題分析:根據“在A、B、C、D、E五種短周期主族元素中,A、B、C三種元素的原子序數依次增大,A、C都能與B按原子個數比為1:1或2:1形成的化合物。”得出:A為H , C 為Na,B為O ,又根據“D的原子最外層電子數最多,E的核電荷數最大,D與E能形成氣態物質ED4,”說明E是ⅣA,核電荷數最大,所以是硅,D是F。
⑴D是氟元素,原子結構示意圖 ,同一周期從左到右原子半徑由大到小,所以Na>Si,O>F,H最小,原子半徑從大到小的順序是Na、Si、O、F、H,答案:
,同一周期從左到右原子半徑由大到小,所以Na>Si,O>F,H最小,原子半徑從大到小的順序是Na、Si、O、F、H,答案:  Na、Si、O、F、H;⑵A與B形成的化合物有H2O、H2O2,含非極性鍵的化合物是H2O2,結構式為H—O—O—H,答案:H—O—O—H;⑶C與B按原子個數比為1:1形成化合物是Na2O2,電子式是
Na、Si、O、F、H;⑵A與B形成的化合物有H2O、H2O2,含非極性鍵的化合物是H2O2,結構式為H—O—O—H,答案:H—O—O—H;⑶C與B按原子個數比為1:1形成化合物是Na2O2,電子式是 ,答案:
,答案: ;⑷F的電負性大于Si,氫化物的穩定性強,答案:HF、SiH4;⑸與B、D同周期元素組成的微粒中,能與N3-.CS2互稱為等電子體的微粒是N2O,、CO2、BeF2,答案:二氧化碳、一氧化二氮、二氟化鈹;⑹工業上制粗硅的方程式為:2C+SiO2
;⑷F的電負性大于Si,氫化物的穩定性強,答案:HF、SiH4;⑸與B、D同周期元素組成的微粒中,能與N3-.CS2互稱為等電子體的微粒是N2O,、CO2、BeF2,答案:二氧化碳、一氧化二氮、二氟化鈹;⑹工業上制粗硅的方程式為:2C+SiO2 Si+2CO↑ ,答案:2C+SiO2
Si+2CO↑ ,答案:2C+SiO2 Si+2CO↑
Si+2CO↑
考點:原子結構與元素周期率的關系,元素及其化合物的性質


科目:高中化學 來源: 題型:填空題
現有A、B、C、D四種短周期元素,已知A、B同主族,B、C、D同周期,A、B的原子序數之和等于C、D的原子序數之和,C的單質能分別跟B和D的最高價氧化物的水化物反應。請回答:
(1)B和C的元素符號分別為_____________________
(2)上述四種元素的原子半徑由大到小的順序為__________________(用元素符號表示)
(3)D單質在A單質中燃燒的產物與二氧化碳反應的化學方程式為_____________________
(4)B單質能跟D的最高價氧化物水化物的濃溶液發生氧化還原反應,生成的兩種鹽的水溶液均呈堿性,該氧化還原反應的離子方程式為_____________________________
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
下表為元素周期表的一部分,其中編號代表對應的元素。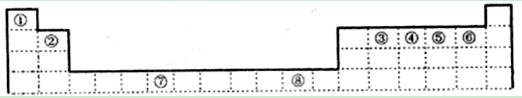
請回答下列問題:
(1)寫出元素⑦的基態原子外圍電子排布式 ,元素⑧位于 區。
⑤元素原子的價層電子的軌道表示式為 ,
(2)若元素①③⑤形成的某化合物顯酸性,經測定這三種元素的質量比為1:6:16,該化合物對氫氣的相對密度為23,則其中所有雜化原子的雜化方式分別為 和 。
(3)元素③④⑤⑥的第一電離能由大到小的順序是 (用元素符號表示)。請寫出由④和⑤兩種元素形成的與N3ˉ互為等電子體的分子的化學式 ,
(寫出一種即可)其VSEPR構型為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
下表為元素周期表的一部分,請參照元素①~⑧在表中的位置,回答下列問題: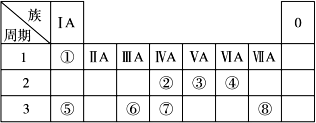
(1)地殼中含量居于第二位的元素在周期表中的位置是________________。
(2)②的最高價氧化物固態時的晶體類型:______________;⑦的最高價氧化物固態時的晶體類型:______________。
(3)①、④、⑤中的某些元素可形成既含離子鍵又含共價鍵的離子化合物,寫出兩種化合物的電子式______________,______________。若用球棍模型表示①和④形成的化合物的分子結構,應該是_____________。
(4)W是第四周期與④同主族的元素。據此推測W不可能具有的性質是( )
| A.最高正化合價為+6價, | B.氣態氫化物比H2S穩定, |
| C.最高價氧化物的水化物的酸性比硫酸弱, | D.單質在常溫下可與氫氣化合。 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
X、Y和Z均為短周期元素,原子序數依次增大,X的單質為密度最小的氣體,Y的最高正價與最低負價的代數和為2,Z與X原子最處層電子數相同。回答下列問題:
(1)X、Y和Z的元素符號分別為 、 、_ 。
(2)選用以上元素組成一種離子化合物,該化合物為______ 。
(3)X和Y組成的化合物Q中,既含有極性共價鍵又含有非極性共價鍵,Q的分子式是 。Q在空氣中點燃時,迅速而安全的燃燒,其反應產物沒有任何污染,燃燒時的化學方程式為 ;Q還可將酸性工業廢水中的Cr2O72-還原為Cr3+,氧化產物為常見氣體。相應的離子方程式為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
短周期元素X、Y、Z、W原子序數依次增大。X氫化物的水溶液顯堿性;Y在元素周期表中所處的周期序數與族序數相等;Z單質是將太陽能轉化為電能的常用材料;W是重要的“成鹽元素”,主要以鈉鹽的形式存在于海水中。請回答:
(l)Y在元素周期表中的位置是__________;X氫化物的電子式是__________。
(2)X氫化物的水溶液與W氫化物的水溶液混合后恰好反應時,溶液呈__________(填“酸”、“堿”或“中”)性,用離子方程式表示其原因是__________。
(3)Y-AgO電池是應用廣泛的魚雷電池,其原理如下圖所示。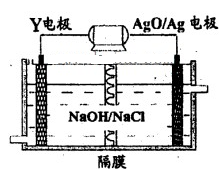
該電池的負極反應式是__________。
(4)Z和W比較,非金屬性較弱的是__________(填元素符號),下列可以驗證這一結論的是__________(填序號)。
a.元素在地殼中的含量
b.最高價氧化物對應水化物的酸性
c.斷開氫化物中1molH-Z或H-W鍵所需的能量
d.Z與W以共價鍵形成化合物時,Z或W顯示的電性
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
常見元素X、Y、Z、W的原子序數依次增大,其相關信息如下表:
| 元素 | 相關信息 |
| X | X的基態原子核外只有三個能級,且各能級電子數相等 |
| Y | Y的基態原子最外層電子數是其內層電子總數的2.5倍 |
| Z | Z的基態價電子結構為nsn-1 |
| W | W單質常在火山口附近被發現,其氧化物是造成酸雨的主要原因之一 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
A、B、C、D是元素周期表前四周期常見的四種元素,原子序數依次增大, 它們的相關結構和性質信息如下表所示,請結合相關信息,完成相關的問題:
| 元素 | 相關結構和性質 |
| A | A為非金屬元素,其一種單質是電的良導體,難熔、質軟并有潤滑性,可用作電極材料 |
| B | 是蛋白質的組成元素之一,原子核外有三種不同能量的電子,且未成對電子數最多 |
| C | 其單質既能與強酸溶液應又能與強堿溶液反應,其簡單離子在第三周期單核離子中半徑最小 |
| D | D的高價氯化物的鹽溶液常用于印刷電路極電路的“刻蝕” |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
已知元素A和B的原子序數都小于18,A元素原子的最外層電子數為a,次外層電子數為b,B元素M層電子數為 a-b,L層電子數為 a+b。請完成下列問題:
(1) 元素A在周期表中的位置
(2) 元素A的原子結構示意圖
(3) 元素B的單質的一種用途
(4) 用B的氧化物的一種用途
(5) B元素的氧化物與NaOH溶液反應的化學方程式
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com