
【題目】氨的合成與應用一直是眾多科學家研究的熱門話題,目前該研究領域已經催生了三位諾貝爾化學獎得主,N2不僅可以與H2合成氨氣,N2還可以與其他物質反應生成氨氣,回答下列相關問題:
(1)德國化學家哈伯研究“N2(g)+3H2(g)![]() 2NH3(g)”反應貢獻巨大,1918年榮獲諾貝爾化學獎,已知該反應在298K時,△H=-92.2 kJ/mol,Kc=4.1×106(mol/L)-2
2NH3(g)”反應貢獻巨大,1918年榮獲諾貝爾化學獎,已知該反應在298K時,△H=-92.2 kJ/mol,Kc=4.1×106(mol/L)-2
①若從平衡常數角度分析,反應限度已經較大,但為何化工生產中還需要使用催化劑:____________________________________________
②升高溫度,反應物的轉化率會降低,而實際化工生產中常常采用700K左右的溫度,其原因是____________________________________________。
(2)1931年,科學家卡爾博施因改進合成氨方法而榮獲該年度諾貝爾化學獎。研究發現,催化劑Fe3O4·Al2O3)顆粒大小不同、溫度不同,平衡混合氣體中氨氣的含量不同由如圖可以得出合成氨的適宜條件是_________________________________

(3)2007年,德國埃特爾發現了合成氨催化機理,開端了表面動力學的研究。研究發現,常溫恒壓密閉容器中,N2在催化劑表面可以與水發生反應:2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g)
4NH3(g)+3O2(g)
①下列各項能夠作為判斷該反應一定達到平衡的依據是___________(填標號)。
A.容器中N2(g)、NH3(g)、O2(g)的濃度之比為2:4:3
B.N2與NH3濃度之比恒定不變
C.v(N2)正=2v(NH3)逆
D.混合氣體中氨氣的質量分數不變
E.壓強保持不變
②平衡后若分別改變下列一個條件,可以使N2轉化率增大的是___________(填標號。)
A.轉移掉部分O2 B.轉移掉部分NH3
C.適當增加H2O(l)的量 D.增加N2的量
(4)科學研究發現,天然氣CH4(g)與N2(g)在催化劑作用下可以直接用于合成氨氣,同時生成副產物焦炭,已知每轉移1mol電子,該反應吸收的熱量為QkJ。
①寫出該反應的熱化學反應方程式_________________________________
②700℃時,將3molCH4與3molN2在2L的恒定密閉容器中發生上述反應,達到平衡時生成 amolC,求此時混合氣體中氨氣的體積分數______________________(用含a的數學表達式即可,下同);該溫度下的平衡常數Kc=_________________________________。
【答案】使用催化劑,主要目的是加快反應速率,提高單位時間內的產量。 該溫度下,催化劑的活性大,催化效率高,反應速率快,此溫度下,雖然反應限度有所降低,但綜合考慮,單位時間內的產量仍較高。 470℃左右、0.6mm粒度大小的催化劑(Fe3O4·Al2O3) B、D A、B 3CH4(g)+2N2(g)![]() 3C(s)+4NH3(g) ΔH=+12QkJ/mol
3C(s)+4NH3(g) ΔH=+12QkJ/mol ![]()
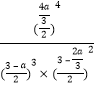
【解析】
(1)①催化劑可以加快化學反應速率,縮短達到平衡所需要的時間,從而可以提高單位時間內的產量。
②合成氨氣的正反應是可逆的放熱反應,升高溫度,化學平衡向逆反應方向移動,使反應物的轉化率會降低,但實際化工生產中常常采用700K左右的溫度,主要原因是在該溫度下催化劑的活性大,催化效率高,反應速率快,綜合考慮,單位時間內的產量仍較高。
(2)根據圖示可知在相同溫度下,顆粒越細小,轉化率越高;相同顆粒,在溫度為470℃左右時轉化率最高,所以最合適的反應條件是470℃左右、0.6mm粒度大小的催化劑(Fe3O4·Al2O3);
(3)①A.方程式中N2(g)、NH3(g)、O2(g)的系數比就是2:4:3,所以N2(g)、NH3(g)、O2(g)的濃度之比為2:4:3可能是反應處于平衡狀態,也可能未達到平衡狀態,不能作為判斷平衡的標志,A錯誤;
B. N2是反應物,NH3是生成物,若二者濃度之比恒定不變,則反應達到平衡狀態,B正確;
C.任何時刻,v(N2)正:v(NH3)正=2:4,若反應達到平衡,則v(NH3)正= v(NH3)逆,則平衡時v(N2)正:v(NH3)逆=2:4,所以2v(N2)正=v(NH3)逆,故該狀態不是平衡狀態,C錯誤;
D. 該反應是反應前后氣體體積不等的反應,若混合氣體中氨氣的質量分數不變,則反應處于平衡狀態,D正確;
E.該反應是在恒溫恒壓下進行,任何時刻壓強保持不變,不能作為判斷平衡的標準,E錯誤;
故合理選項是BD;
②A.轉移掉部分O2,即減小生成物濃度,平衡正向移動,可以提高N2轉化率,A正確;
B.轉移掉部分NH3,即減小生成物濃度,平衡正向移動,可以提高N2轉化率,B正確;
C.由于水的狀態是液態,改變其物質的量,平衡不移動,所以不能改變N2轉化率,C錯誤;
D.增加N2的量,該物質本身濃度增大,平衡正向移動,但是平衡正向移動消耗量小于加入量,總的來說它的轉化率還是降低,D錯誤;
故合理選項是AB;
(4) ①根據題意,結合原子守恒、電子守恒,可得熱化學方程式:3CH4(g)+2N2(g)![]() 3C(s)+4NH3(g) ΔH=+12QkJ/mol;
3C(s)+4NH3(g) ΔH=+12QkJ/mol;
② 3CH4(g)+2N2(g)![]() 3C(s)+4NH3(g) ΔH=+12QkJ/mol
3C(s)+4NH3(g) ΔH=+12QkJ/mol
n(開始) (mol) 3 3 0 0
n(轉化) (mol) a ![]() a
a ![]()
n(平衡) (mol) 3-a 3-![]() a
a ![]()
所以達到平衡時混合氣體中氨氣的體積分數是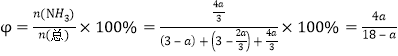 ;
;
根據平衡常數的含義可得:該溫度下的平衡常數Kc=


科目:高中化學 來源: 題型:
【題目】化合物G是一種低毒性、低殘留、環境友好的農藥,可以通過以下方法合成。

(1)A→B的反應類型為______________。
(2)下列說法不正確的是________。
A.化合物B能使Br2/CCl4溶液褪色 B.化合物A能發生銀鏡反應
C.化合物C能與FeCl3發生顯色反應 D.化合物E的分子式為C12H12Cl2O2
(3)化合物C中的含氧官能團名稱為________和________。
(4)化合物X的分子式為C5H12O2,則X的結構簡式為______________。
(5)寫出同時滿足下列條件的D的一種同分異構體的結構簡式:__________。①屬于芳香族化合物且能發生銀鏡反應②分子中只有3種不同化學環境的氫
(6)請以![]() 為原料制備化合物
為原料制備化合物![]() ,寫出相應的合成路線流程圖(無機試劑任用,合成路線流程圖示例見本題題干)。_________________。
,寫出相應的合成路線流程圖(無機試劑任用,合成路線流程圖示例見本題題干)。_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時, 在pH都等于5的NH4Cl和CH3COOH兩種溶液中,設由水電離產生的H+ 離子濃度分別為Amol/L與Bmol/L,則A和B關系為
A. A < B B. A = 10-4 B C. B = 10-4 A D. A = B
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列方程式表達正確的是
A. 碳酸鋇跟醋酸反應:BaCO3+2CH3COOH=Ba2++2CH3COO-+CO2↑+H2O
B. 碳酸氫鈉溶于水的電離方程式:NaHCO3![]() Na++H++CO32-
Na++H++CO32-
C. 硫酸銨溶液和氫氧化鋇溶液反應:Ba2++SO42-=BaSO4↓
D. 氧化鈉固體上滴加稀鹽酸:O2-+2H+=H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:Ag2SO4微溶于水,可溶于硝酸。溶液X中可能含有Na+、Ca2+、Fe2+、Cl—、Br—、CO32-、SiO32-、SO42-中的幾種離子。為了確定其組成,某同學進行了如下實驗:

下列說法正確的是
A.溶液X中一定不含Ca2+、Br—、Fe2+
B.溶液X中一定含有Na+、Cl—和SiO32-
C.為確定溶液X中是否含有SO42-,可取溶液2,加入BaCl2溶液
D.白色沉淀為AgCl和Ag2SO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將同體積同物質的量濃度的NaCl、MgCl2、AlCl3三種溶液中的Cl-完全沉淀,則需同物質的量濃度的AgNO3溶液的體積比為 ( )
A. 1∶2∶3 B. 3∶2∶1 C. 1∶1∶1 D. 6∶3∶2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com