
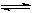 CH3OH(g) + H2O(g) △H=" -49.0" kJ·mol-1
CH3OH(g) + H2O(g) △H=" -49.0" kJ·mol-1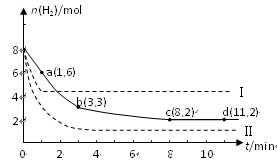
科目:高中化學 來源:不詳 題型:單選題
A.用坩堝灼燒MgCl2·6H2O的反應式 MgCl2·6H2O MgCl2+6H2O MgCl2+6H2O |
| B.根據下表提供的數據,等物質的量濃度的NaClO、NaHCO3混合溶液中,有c(HCO3-)>c(ClO-)>c(OH-) 。 化學式 電離常數 HClO K1=3×10-8 H2CO3 K1=4.3×10-7 K2=5.6×10-11 |
| C.常溫下,將pH=2的稀硫酸稀釋10倍,其中各離子的物質的量濃度都變為原來的十分之一。 |
| D.某溫度時,BaSO4在水中的沉淀溶解平衡曲線如圖所示,溶度積常數CKsp=c(Ba2+)·c(SO42-)。則加入 Na2SO4可使溶液由a點變到b點;通過蒸發可以使溶液由d 點變到c 點。 |

查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 2YX3(g) △H 反應各物質的量濃度隨時間變化如下:
2YX3(g) △H 反應各物質的量濃度隨時間變化如下:
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.化學反應速率理論是研究怎樣在一定時間內快出產品 |
| B.化學平衡理論是研究怎樣使用有限原料多出產品 |
| C.化學反應速率理論是研究怎樣提高原料轉化率 |
| D.化學平衡理論是研究怎樣使原料盡可能多地轉化為產品 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.-Y kJ/mol | B.-(10X-Y) kJ/mol |
| C.-(5X-0.5Y) kJ/mol | D.+(10X-Y) kJ/mol |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.怎樣在一定時間內快出產品是運用了化學反應速率理論 |
| B.怎樣使用有限原料多出產品是運用了化學平衡理論 |
| C.怎樣提高原料轉化率是運用了化學反應速率理論 |
| D.怎樣使原料盡可能多地轉化為產品是運用了化學平衡理論 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.0.6 mol | B.1.8 mol | C.1.2 mol | D.1.5 mol |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題


 ,
, ,在某溫度時
,在某溫度時 的濃度隨時間變化的曲線:
的濃度隨時間變化的曲線: 下列有關該反應的描述正確的是
下列有關該反應的描述正確的是A.第6 后,反應就終止了 后,反應就終止了 |
B. 的平衡轉化率為85% 的平衡轉化率為85% |
C.若升高溫度, 的平衡轉化率將大于85% 的平衡轉化率將大于85% |
| D.若降低溫度,v正> v逆 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com