
【題目】燃料電池是目前電池研究的熱點之一。某課外小組自制的氫氧燃料電池如圖所示,a、b均為惰性電極。下列敘述正確的是

A. 溶液中的K+移向b電極
B. a極的電極反應式為:2H++2e—= H2↑
C. b極為負極,該電極上發生氧化反應
D. 電子由a極經電解質溶液移向b極
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】已知下列反應的熱化學方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
2 H2(g)+ O2(g)= 2H2O(g)△H2
C(s)+ O2(g)=CO2(g)△H3
則反應4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H為
A. 12△H3+5△H2-2△H1 B. 2△H1-5△H2-12△H3
C. 12△H3-5△H2-2△H1 D. △H1-5△H2-12△H3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳是形成化合物種類最多的元素,其單質及化合物是人類生產生活的主要能源物質。
請回答下列問題:
(1)有機物M經過太陽光光照可轉化成N,轉化過程如下:
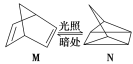 ΔH=+88.6 kJ·mol-1
ΔH=+88.6 kJ·mol-1
則M、N相比,較穩定的是 。
(2)已知CH3OH(l)的燃燒熱為238.6 kJ·mol-1,CH3OH(l)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,則a 238.6(填“>”、“<”或“=”)。
O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,則a 238.6(填“>”、“<”或“=”)。
(3)使Cl2和H2O(g)通過灼熱的炭層,生成HCl和CO2,當有1 mol Cl2參與反應時釋放出145 kJ熱量,寫出該反應的熱化學方程式: 。
(4)火箭和導彈表面的薄層是耐高溫物質。將石墨、鋁粉和二氧化鈦按一定比例混合在高溫下煅燒,所得物質可作耐高溫材料,4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1 176 kJ·mol-1,則反應過程中,每轉移1 mol電子放出的熱量為 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)甲醇是一種重要的化工產品,可利用甲醇催化脫氫制備甲醛。甲醛與氣態甲醇轉化的能量關系如圖所示。

反應過程中的能量關系
①甲醇催化脫氫轉化為甲醛的反應是________(填“吸熱”或“放熱”)反應。
②過程Ⅰ與過程Ⅱ的反應熱是否相同?____________原因是_______________。
③寫出甲醇催化脫氫轉化為甲醛的熱化學反應方程式_________________________________。
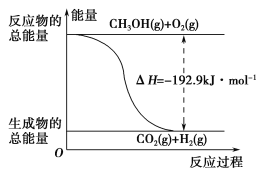
(2)已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列說法正確的是________。
A.CH3OH轉變成H2的過程一定要吸收能量
B.①反應中,反應物的總能量高于生成物的總能量
C.根據②推知反應:CH3OH(l)+![]() O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
D.反應②的能量變化如圖所示
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物w用作調香劑、高分子材料合成的中間體等,制備W的一種合成路線如下:

已知![]()
請回答下列問題
(1)F的名稱是__________⑤的反應類型是__________。
(2)E中的含氧官能團的名稱為__________,W的結構簡式為__________。
(3)反應②的化學方程式是__________。
(4)D自身還能發生聚合反應,其聚合產物的結構簡式為__________。
(5)參照有機物W的上述合成路線,設計以M為起始原料制備F的合成路線(其他試劑任選) __________。
示例:CH3CH2OH![]() CH2=CH2
CH2=CH2![]() BrCH2CH2Br
BrCH2CH2Br
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.鎵(Ga)位于周期表的第四周期,與Al同主族,主要存在Ga3+、GaO2-兩種離子形式,被廣泛應用于電子工業。
(1)用鋁粉和Fe2O3做鋁熱反應實驗,需要的試劑還有__________________。
a.KClO3 b. KCl c. MnO2 d. Mg
(2)半導體材料氮化鎵由Ga與NH3在一定條件下發生置換反應生成。該過程每生成1molGaN(s)放出熱量15.4kJ。鎵在周期表中的序號_____________,寫出該反應的熱化學方程式_________________。
(3)工業上用電解法精煉鎵。具體原理如圖所示,已知:金屬的活動性Zn>Ga>Fe>Cu

①電解精煉鎵一段時間后形成的陽極泥主要有______________
②已知精煉時陰極反應:GaO2-+3e-+2H2O=Ga+4OH- 。陽極的電極反應方程式:___________________________________;
Ⅱ.用廢鐵皮制取鐵紅(Fe2O3)的部分流程示意圖如下:

(4)步驟I溫度不能過高。因為:_______________________________。
(5)步驟II中發生反應4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,生成的硝酸又將廢鐵皮中的鐵轉化為Fe(NO3)2。
寫出后者反應的離子方程式______________________________________。
(6)上述生產流程中,能體現“綠色化學”思想的是______________________ 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com