
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
| X元素的基態原子中電子分布在三個不同的能級中,且每個能級中的電子總數相同 |
| Y元素的氣態氫化物與其最高價氧化物對應的水化物能發生化合反應 |
| Z元素的族序數是其周期數的三倍 |
| W原子的第一至第六電離能分別為:I1=578kJ?mol-1;I2=1817kJ?mol-1;I3=2745kJ?mol-1; I4=11575kJ?mol-1 ;I5=14830kJ?mol-1 ;I6=18376kJ?mol-1 |
| Q為前四周期中電負性最小的元素 |
| 元素R位于周期表的第10列 |

查看答案和解析>>
科目:高中化學 來源: 題型:
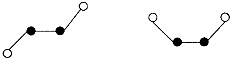
2+ 0.45 |
3+ 0.5 |
2+ 0.25 |
3+ 0.70 |
2+ 0.15 |
3+ 0.80 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 元素 | 相關信息 |
| T | T原子所處的周期數、族序數分別與其原子序數相等 |
| X | X的基態原子中電子占據三種能量不同的原子軌道,且每種軌道中的電子數相同 |
| Z | Z的基態原子價電子排布為ns2npn+2 |
| Q | 在該元素所在周期中,Q的基態原子的第一電離能最小 |
| R | 3p能級上有1個電子 |
| W | W的一種核素的質量數為65,中子數為36 |
查看答案和解析>>
科目:高中化學 來源:2012-2013學年陜西省西安市高三第一次質檢化學試卷(解析版) 題型:推斷題
W、Y、Z、Q、R是周期表中前四周期的元素,且原子序數依次增大。W原子核外有2個未成對電子,Q是電負性最大的元素,R元素的原子核外的未成對電子數是W原子核外未成對電子數的2倍。請回答下列問題(答題時,W、Y、Z、Q、R用所對應的元素符號表示):
(l)W、Y、Z 三種元素的第一電離能由大到小的順序為 。在上述三種元素的原子中,寫出與WZ2互為等電子體的分子式 。
(2)已知Y2Q2分子存在如下所示的兩種結構(球棍模型,短線不一定代表單鍵)

該分子中Y原子的雜化方式是 雜化。
(3)W2-2陰離子的電子式為 ,Z原子最外層電子排布式為 。
(4)YQ3分子的空間構型為 ,Y和Q兩元素的氫化物的沸點相比較,高者是 (寫分子式).往硫酸銅溶液中通入過量的YH3(Y的氫化物分子式),可生成配離子[Cu(YH3)4]2+,但YQ3不易與Cu2+形成配離子,其原因是 。
(5)科學家通過X射線探明RZ的晶體結構與NaCl晶體結構相似。那么在RZ晶體中距離R2+最近且等距離的R2+有 個。若在RZ晶體中陰陽離子間最近距離為a cm,晶體密度為ρg/cm3,則阿伏伽德羅常數NA的表達式為 mol-1。
(6)已知非整數比化合物R0.95Z,其晶體結構與NaCI相似,但由于R、Z離子個數比小于1:1,故晶體存在缺陷。R0.95Z可表示為( )

查看答案和解析>>
科目:高中化學 來源:2010-2011學年安徽省名校高三聯考(理綜)化學部分 題型:填空題
T、X、Y、Z、Q、R、W為周期表前四周期元素,原子序數依次遞增,其相關信息如下表:
|
元素 |
相關信息 |
|
T |
T原子所處的周期數、族序數分別與其原子序數相等 |
|
X |
X的基態原子中電子占據三種能量不同的原子軌道,且每種軌道中的電子數相同 |
|
Z |
Z的基態原子價電子排布為 |
|
Q |
在該元素所在周期中,Q的基態原子的第一電離能最小 |
|
R |
3p能級上有1個電子 |
|
W |
W的一種核素的質量數為65,中子數為36 |
(1)X、Y、Q三種元素的電負性由大到小的順序是 (用元素符號表示)。
(2)X與Y原子結合形成的X3Y4晶體,其硬度比金剛石大,則X3Y4晶體中含有 鍵(填“共價”、“離子”、“金屬”),屬于 晶體(填“分子”、“原子”、“離子”)。
(3)W的基態原子的核外電子排布式為 。利用電解可提純W物質,在該電解反應中陽極物質是 ,陰極物質是 ,電解質溶液是 。
(4)T、X兩種元素組成的一種化合物M是重要的化工原料,常把它的產量作為衡量石油化工發展水平的標志,則M分子中 鍵和
鍵和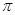 鍵的個數比為 。在T—Y、T—Z兩種共價鍵中,鍵長較長的是
。
鍵的個數比為 。在T—Y、T—Z兩種共價鍵中,鍵長較長的是
。
(5)已知25℃、101 kPa條件下:
4R(s)+3Z2(g) 2R2Z3(s) △H=-2834.9 kJ/mol
4R(s)+2Z3(g) 2R2Z3(s) △H=-3119.1 kJ/mol
則16g Z2(g)完全轉化為Z3(g)的△H= .
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com