
(12分)我國是個鋼鐵大國,鋼鐵產量為世界第一,高爐煉鐵是最為普遍的煉鐵方法。高爐內可能發生如下反應:
C(s)+O2(g) = CO2(g) △H1=-393.5kJ·mol—1 ①
C(s)+CO2(g) = 2CO(g) △H2=+172.5kJ·mol—1 ②
4CO(g)+Fe3O4(s) = 4CO2(g)+3Fe(s) △H3=-13.7 kJ·mol—1 ③
請回答下列問題:
⑴計算3Fe(s)+2O2(g) =Fe3O4(s)的△H=___________________。
⑵800℃時,C(s)+CO2(g)2CO(g)的平衡常數K=1.64,相同條件下測得高爐內c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此時反應向_______(填“正”或“逆”)方向進行。
⑶某種礦石中鐵元素以氧化物FemOn形式存在,現進行如下實驗:將少量鐵礦石樣品粉碎,稱取25.0 g樣品于燒杯中,加入稀硫酸充分溶解,并不斷加熱、攪拌,濾去不溶物。向所得濾液中加入10.0 g銅粉充分反應后過濾、洗滌、干燥得剩余固體3.6 g。剩下濾液用濃度為2 mol·L-1的酸性KMnO4滴定,至終點時消耗KMnO4溶液體積25.0 mL。
提示:2Fe3++Cu=2Fe2++Cu2+ 8H++MnO4-+5Fe2+=Mn2++5Fe3++4H2O
①計算該鐵礦石中鐵元素的質量分數。(請寫出必要的解題步驟)
②計算氧化物FemOn的化學式(m、n為正整數)(請寫出必要的解題步驟)
科目:高中化學 來源: 題型:
(12分)我國是個鋼鐵大國,鋼鐵產量為世界第一,高爐煉鐵是最為普遍的煉鐵方法。高爐內可能發生如下反應:
C(s)+O2(g)= CO2(g) △H1=-393.5 kJ·mol—1 ①
C(s)+CO2(g) =2CO(g) △H2=+172.5 kJ·mol—1 ②
4CO(g)+Fe3O4(s)= 4CO2(g)+3Fe(s) △H3=-13.7 kJ·mol—1 ③
請回答下列問題:
⑴計算3Fe(s)+2O2(g) = Fe3O4(s)的△H=___________________。
⑵800℃時,C(s)+CO2(g)2CO(g)的平衡常數K=1.64,相同條件下測得高爐內c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此時反應向_______(填“正”或“逆”)方向進行。
⑶某種礦石中鐵元素以氧化物FemOn形式存在,現進行如下實驗:將少量鐵礦石樣品粉碎,稱取25.0 g樣品于燒杯中,加入稀硫酸充分溶解,并不斷加熱、攪拌,濾去不溶物。向所得濾液中加入10.0 g銅粉充分反應后過濾、洗滌、干燥得剩余固體3.6 g。剩下濾液用濃度為2 mol·L-1的酸性KMnO4滴定,至終點時消耗KMnO4溶液體積25.0 mL。
提示:2Fe3++Cu=2Fe2++Cu2+ 8H++MnO4-+5Fe2+=Mn2++5Fe3++4H2O
①計算該鐵礦石中鐵元素的質量分數。(請寫出必要的解題步驟)
②計算氧化物FemOn的化學式(m、n為正整數)(請寫出必要的解題步驟)
查看答案和解析>>
科目:高中化學 來源:2012屆江蘇省阜寧高中、大豐高中、栟茶高中高三第二次調研聯考化學試卷 題型:填空題
(12分)我國是個鋼鐵大國,鋼鐵產量為世界第一,高爐煉鐵是最為普遍的煉鐵方法。高爐內可能發生如下反應:
C(s)+O2(g) = CO2(g) △H1=-393.5 kJ·mol—1 ①
C(s)+CO2(g) = 2CO(g) △H2=+172.5 kJ·mol—1 ②
4CO(g )+Fe3O4(s) = 4CO2(g)+3Fe(s) △H3=-13.7 kJ·mol—1 ③
)+Fe3O4(s) = 4CO2(g)+3Fe(s) △H3=-13.7 kJ·mol—1 ③
請回答下列問題:
⑴計算3Fe(s)+2O2(g) = Fe3O4(s)的△H=___________________。
⑵8 00℃時,C(s)+CO2(g)
00℃時,C(s)+CO2(g) 2CO(g)的平衡常數K=1.64,相同條件下測得高爐內c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此時反應向_______(填“正”或“逆”)方向進行。
2CO(g)的平衡常數K=1.64,相同條件下測得高爐內c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此時反應向_______(填“正”或“逆”)方向進行。
⑶某種礦石中鐵元素以氧化物FemOn形式存在,現進行如下實驗:將少量鐵礦石樣品粉碎,稱取25.0 g樣品于燒杯中,加入稀硫酸充分溶解,并不斷加熱、攪拌,濾去不溶物。向所得濾液中加入10.0 g銅粉充分反應后過濾、洗滌、干燥得剩余固體3.6 g。剩下濾液用濃度為2 mol·L-1的酸性KMnO4滴定,至終點時消耗KMnO4溶液體積25.0 mL。
提示:2Fe3++Cu=2Fe2++Cu2+ 8H++MnO4-+5Fe2+=Mn2++5Fe3++4H2O
①計算該鐵礦石中鐵元素的質量分數。(請寫出必要的解題步驟)
②計算氧化物FemOn的化學式(m、n為正整數)(請寫出必要的解題步驟)
查看答案和解析>>
科目:高中化學 來源:2011-2012學年江蘇省、大豐高中、栟茶高中高三第二次調研聯考化學試卷 題型:填空題
(12分)我國是個鋼鐵大國,鋼鐵產量為世界第一,高爐煉鐵是最為普遍的煉鐵方法。高爐內可能發生如下反應:
C(s)+O2(g) = CO2(g) △H1=-393.5 kJ·mol—1 ①
C(s)+CO2(g) = 2CO(g) △H2=+172.5 kJ·mol—1 ②
4CO(g)+Fe3O4(s) = 4CO2(g)+3Fe(s) △H3=-13.7 kJ·mol—1 ③
請回答下列問題:
⑴計算3Fe(s)+2O2(g) = Fe3O4(s)的△H=___________________。
⑵800℃時,C(s)+CO2(g)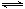 2CO(g)的平衡常數K=1.64,相同條件下測得高爐內c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此時反應向_______(填“正”或“逆”)方向進行。
2CO(g)的平衡常數K=1.64,相同條件下測得高爐內c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此時反應向_______(填“正”或“逆”)方向進行。
⑶某種礦石中鐵元素以氧化物FemOn形式存在,現進行如下實驗:將少量鐵礦石樣品粉碎,稱取25.0 g樣品于燒杯中,加入稀硫酸充分溶解,并不斷加熱、攪拌,濾去不溶物。向所得濾液中加入10.0 g銅粉充分反應后過濾、洗滌、干燥得剩余固體3.6 g。剩下濾液用濃度為2 mol·L-1的酸性KMnO4滴定,至終點時消耗KMnO4溶液體積25.0 mL。
提示:2Fe3++Cu=2Fe2++Cu2+ 8H++MnO4-+5Fe2+=Mn2++5Fe3++4H2O
①計算該鐵礦石中鐵元素的質量分數。(請寫出必要的解題步驟)
②計算氧化物FemOn的化學式(m、n為正整數)(請寫出必要的解題步驟)
查看答案和解析>>
科目:高中化學 來源:2011-2012學年江蘇省高三第二次調研聯考化學試卷 題型:填空題
(12分)我國是個鋼鐵大國,鋼鐵產量為世界第一,高爐煉鐵是最為普遍的煉鐵方法。高爐內可能發生如下反應:
C(s)+O2(g) = CO2(g) △H1=-393.5 kJ·mol—1 ①
C(s)+CO2(g) = 2CO(g) △H2=+172.5 kJ·mol—1 ②
4CO(g)+Fe3O4(s) = 4CO2(g)+3Fe(s) △H3=-13.7 kJ·mol—1 ③
請回答下列問題:
⑴計算3Fe(s)+2O2(g) = Fe3O4(s)的△H=___________________。
⑵800℃時,C(s)+CO2(g)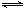 2CO(g)的平衡常數K=1.64,相同條件下測得高爐內c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此時反應向_______(填“正”或“逆”)方向進行。
2CO(g)的平衡常數K=1.64,相同條件下測得高爐內c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此時反應向_______(填“正”或“逆”)方向進行。
⑶某種礦石中鐵元素以氧化物FemOn形式存在,現進行如下實驗:將少量鐵礦石樣品粉碎,稱取25.0 g樣品于燒杯中,加入稀硫酸充分溶解,并不斷加熱、攪拌,濾去不溶物。向所得濾液中加入10.0 g銅粉充分反應后過濾、洗滌、干燥得剩余固體3.6 g。剩下濾液用濃度為2 mol·L-1的酸性KMnO4滴定,至終點時消耗KMnO4溶液體積25.0 mL。
提示:2Fe3++Cu=2Fe2++Cu2+ 8H++MnO4-+5Fe2+=Mn2++5Fe3++4H2O
①計算該鐵礦石中鐵元素的質量分數。(請寫出必要的解題步驟)
②計算氧化物FemOn的化學式(m、n為正整數)(請寫出必要的解題步驟)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com