
NA為阿伏加德羅常數的值。下列說法中,正確的是
A.常溫常壓下,l.6g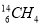 中含有共價鍵總數為0.4NA
中含有共價鍵總數為0.4NA
B.密閉容器中2molNO與1molO2充分反應后,容器內氣體的分子數為2NA
C.1L0.lmol·L-1的CH3COONa溶液中CH3COO-和CH3COOH粒子數之和為0.1NA
D.過氧化鈉與水反應時,生成0.1mol氧氣轉移的電子數為0.4NA
 暑假作業海燕出版社系列答案
暑假作業海燕出版社系列答案 本土教輔贏在暑假高效假期總復習云南科技出版社系列答案
本土教輔贏在暑假高效假期總復習云南科技出版社系列答案 暑假作業北京藝術與科學電子出版社系列答案
暑假作業北京藝術與科學電子出版社系列答案科目:高中化學 來源:2016屆吉林省吉林市高三第三次調研理綜化學試卷(解析版) 題型:實驗題
TiCl4是生產金屬鈦和鈦白的原料,工業上主要用TiO2氯化的方法來制取。某化學實驗小組以8.0g TiO2和足量 CCl4為原料制取TiCl4。裝置圖如下:
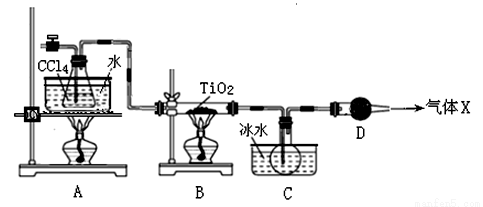
下表是有關物質的性質:
物質 | 熔點/℃ | 沸點/℃ | 其他 |
CCl4 | ﹣23 | 76.8 | 與TiCl4互溶 |
TiCl4 | ﹣25 | 136 | 遇潮濕空氣產生白霧 |
請回答下列問題
(1)TiCl4中化學鍵的類型是 。
(2)B中TiO2發生反應的化學方程式是 。
(3)X氣體的主要成分是 。
(4)實驗開始時先點燃A處的酒精燈,待C中燒瓶里有液滴出現時再點燃B處的酒精燈,其主要目的是 。
(5)欲分離C裝置中的TiCl4,應采用的實驗操作為 (填操作名稱)。
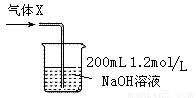
(6)若將反應過程中生成的氣體X全部通入到下圖所示的裝置中充分反應,生成的鹽是 (填化學式),生成鹽的總物質的量n≤ 。
查看答案和解析>>
科目:高中化學 來源:2016屆四川省宜賓縣高三第一次適應性測試理綜化學試卷(解析版) 題型:實驗題
W結構中含有三個六元環,是一種新型香料的主要成分之一。W的合成路線如下(部分產物和部分反應條件略去):
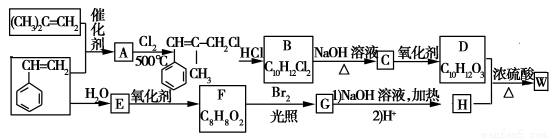
已知:①RCH===CH2+CH2===CHR′CH2===CH2+RCH===CHR′
②B中核磁共振氫譜圖顯示分子中有6種不同環境的氫原子
③D和H是同系物
請回答下列問題:
(1)G分子中含有的官能團名稱是 。
(2)A→B反應過程中涉及的反應類型有 、 。
(3)W的結構簡式為 。
(4)B→C的化學方程式為 ;由D生成高分子化合物的方程式為 。[
(5)同時滿足下列條件的F的同分異構體有 種(不包括立體異構):
①能發生銀鏡反應;②能發生水解反應。
其中核磁共振氫譜為5組峰的為 (寫結構簡式),其峰面積之比為 。
查看答案和解析>>
科目:高中化學 來源:2016屆天津市和平區高三第二次模擬考試化學試卷(解析版) 題型:選擇題
下列有關實驗操作的說法正確的是( )。
A.可用25mL堿式滴定管量取20.00mL KMnO4溶液
B.用pH試紙測定溶液的pH時,需先用蒸餾水潤濕試紙
C.將金屬鈉在研缽中研成粉末,使鈉與水反應的實驗更安全
D.蒸餾時蒸餾燒瓶中液體的體積不能超過容積的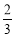 ,液體也不能蒸干
,液體也不能蒸干
查看答案和解析>>
科目:高中化學 來源:2016屆寧夏銀川市高三4月質檢理綜化學試卷(解析版) 題型:填空題
硫單質及其化合物在工農業生產中有著重要的應用。請回答下列問題:
(1)一種煤炭脫硫技術可以把硫元素以CaSO4的形成固定下來,但產生的CO又會與CaSO4發生化學反應,相關的熱化學方程式如下:
①CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g)△H = +210.5kJ•mol-1
CaO(s)+SO2(g)+CO2(g)△H = +210.5kJ•mol-1
②1/4CaSO4(s)+CO(g) 1/4CaS(s)+CO2(g) △H = - 47.3kJ•mol-1
1/4CaS(s)+CO2(g) △H = - 47.3kJ•mol-1
反應CaO(s)+3CO(g)+SO2(g)  CaS(s)+3CO2(g) △H= kJ•mol-1;
CaS(s)+3CO2(g) △H= kJ•mol-1;
平衡常數K的表達式為 。
(2)圖1為在密閉容器中H2S氣體分解生成H2和S2(g)的平衡轉化率與溫度、壓強的關系。

圖1中壓強p1、p2、p3的大小順序為 ,理由是 ;該反應平衡常數的大小關系為K(T1) K(T2) (填“>”、“<”或“=”),理由是 。
(3)在一定條件下,二氧化硫和氧氣發生如下反應:2SO2(g)+O2(g)  2SO3(g) △H<0
2SO3(g) △H<0
①600℃時,在一密閉容器中,將二氧化硫和氧氣混合,反應過程中SO2、O2、SO3物質的量變化如圖2,反應處于平衡狀態的時間段是 。
②據圖2判斷,反應進行至20min時,曲線發生變化的原因是 (用文字表達);10min到15min的曲線變化的原因可能是 (填寫編號)。
A.加了催化劑 B.縮小容器體積
C.降低溫度 D.增加SO3的物質的量
(4)煙氣中的SO2可用某濃度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,該溶液中c(Na+)= (用含硫微粒濃度的代數式表示)。
查看答案和解析>>
科目:高中化學 來源:2016屆山東省高三5月模擬一理綜化學試卷(解析版) 題型:填空題
[化學—選修3:物質結構與性質]
周期表前四周期的元素a、b、c、d、e,原子序數依次增大。a的核外電子總數與其周期數相同,b的價電子層中的未成對電子有3個,c的最外層電子數為其內層電子數的3倍,d與c同族,e的最外層只有1個電子,但次外層有18個電子。請填寫下列空白。
(1)e元素基態原子的核外電子排布式為____________。
(2)b、c、d三種元素的第一電離能數值由小到大的順序為____________(填元素符號),其原因是__________________。
(3)a和其他元素形成的二元共價化合物中,分子呈三角錐形,該分子的中心原子的雜化方式為 ;分子中既含有極性共價鍵,又含有非極性共價鍵的化合物是 (填化學式,寫出兩種)。
(4)已知c、e能形成晶胞如圖甲和圖乙所示的兩種化合物,化合物的化學式為分別為:甲____,乙____;甲高溫易轉化為乙的原因是__________________。
(5)這5種元素形成的一種1∶1型離子化合物中,陰離子呈四面體結構;陽離子呈軸向狹長的八面體結構(如圖丙所示)。該化合物中,陰離子為 ,,該化合物加熱時首先失去的組分是 ,判斷理由是__________________。
查看答案和解析>>
科目:高中化學 來源:2016屆山東省高三5月模擬一理綜化學試卷(解析版) 題型:選擇題
2015年中美專家研制出可在一分鐘內完成充電的超常性能鋁離子電池,分別以金屬鋁和石墨為電極,用AlCl4-、A12C17-和有機陽離子組成電解質溶液,其放電工作原理如右圖所示。下列說法不正確的是

A.放電時,鋁為負極、石墨為正極
B.充電時的陽極反應為:Cn+AlCl4--e-=CnAlCl4
C.放電時的負極反應為:Al-3e-+7AlCl4-=4A12C17-
D.放電時,有機陽離子向鋁電極方向移動
查看答案和解析>>
科目:高中化學 來源:2015-2016學年海南嘉積中學高二下期中理科化學試卷(解析版) 題型:選擇題
某炔烴經催化加氫后,得到2-甲基丁烷,該炔烴是
A.2-甲基-1-丁炔 B.2-甲基-3-丁炔 C.3-甲基-1-丁炔 D.3-甲基-2-丁炔
查看答案和解析>>
科目:高中化學 來源:2015-2016學年四川成都石室中學高二4月月考化學試卷(解析版) 題型:實驗題
醫療上綠礬(FeSO4•7H2O)是治療缺鐵性貧血的特效藥。某化學興趣小組對綠礬進行了如下的探究:
Ⅰ.【制備產品】
該小組由廢鐵屑(含少量氧化銅、氧化鐵等雜質),用如圖所示裝置制備 FeSO4 •7H2O晶體,步驟如下:
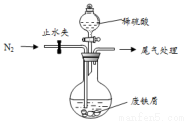
(1)預處理:先將廢鐵屑加入到飽和 Na2CO3溶液中洗滌,目的是__________ ,然后將廢鐵屑用水洗滌 2~3 遍。
(2)將洗滌后的廢鐵屑加入到圓底燒瓶中,并持續通入N2
(3)再加入足量稀硫酸,控制溫度 50℃~80℃之間,充分反應后,圓底燒瓶中剩余的固體為__________ 。實驗室常用鐵氰化鉀溶液檢驗反應生成的Fe2+,寫出該反應的離子反應方程式:______________;
(4)獲取產品:先向步驟(3)中反應后的混合物中加入少許蒸餾水,趁熱過濾,冷卻結晶,濾出晶體,用少量冰水洗滌 2~3 次,再用濾紙將晶體吸干,密閉保存。
Ⅱ.【測定FeSO4 •7H2O 含量】
(1)稱取上述樣品 10.0g,溶于適量的稀硫酸中,配成 100mL 溶液,準確量取 25.00mL 該液體于錐形瓶中,用 0.1000mol/L KMnO4標準溶液滴定滴定3次,平均消耗 10.00mL標準液,該樣品中 FeSO4 •7H2O 的質量分數為________ 。(已知 Mr(FeSO4 •7H2O)=278)。
(2)若測量結果偏小,則可能是在定容時________(填“俯視”或“仰視”)讀數。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com