
【題目】氯化亞銅(CuCl)常用作有機合成工業中的催化劑,是一種白色粉末;微溶于水、不溶于乙醇及稀硫酸。工業用如下流程,從酸性廢液(主要含Cu2+、Fe3+、 H+、Cl-)中制備氯化亞銅。
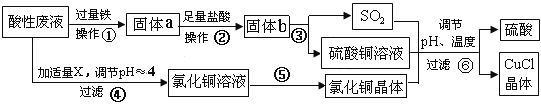
請回答下列問題:
(1)寫出步驟①中發生的兩個主要反應的離子方程式:_________________________。
(2)步驟②的操作名稱是:_____________。
(3)步驟④中所加物質X為:__________。
(4)步驟⑤的操作是:___________________________________________________。
(5)步驟⑥應調節溶液pH呈酸性,且用乙醇洗滌CuCl晶體,目的是:______________。
(6)在CuCl的生成過程中,可以循環利用的物質是______________,理論上_____(填“是”或“否”)需要補充(不考慮調節等消耗);理由是__________________________________。
(7)工業上還可以采用以碳棒為電極電解CuCl2溶液得到CuCl。寫出電解CuCl2溶液中的陰極上發生的電極反應 ___________________________________________。
【答案】 Cu2++ Fe = Cu+ Fe2+ Fe + 2Fe3+= 3Fe2+或Fe + 2H+= Fe2++ H2↑ 過濾、洗滌 CuO或Cu (OH)2或CuCO3等 在HCl足量的情況下蒸發結晶 減少CuCl的損失 硫酸(或H2SO4) 否 Cu與濃硫酸反應生成CuSO4和SO2的物質的量為1∶1,而生產CuCl的過程中消耗CuSO4和SO2的物質的量也為1﹕1,所以理論上不需要補充H2SO4 Cu2++Cl-+e-= CuCl
【解析】試題分析:從某酸性廢液(主要含Cu2+、Fe3+、H+、Cl-)中制備氯化亞銅,向工業上以某酸性廢液(含Cu2+、Fe3+、H+、Cl-)加入過量的鐵粉,三價鐵離子與鐵粉反應轉化為二價鐵離子,銅離子與鐵反應生成銅,然后過濾,濾渣為過量的鐵和生成的銅,依據銅與鐵活潑性,將濾渣溶于鹽酸,銅與鹽酸不反應,過濾得到濾渣即為銅,然后銅與濃硫酸反應生成硫酸銅和二氧化硫,酸性廢液調節pH值使鐵離子沉淀,過濾得氯化銅溶液,氯化銅、硫酸銅、二氧化硫反應生成氯化亞銅和硫酸,硫酸可以再循環利用,
(1)步驟①中鐵能與銅離子及鐵離子反應生成銅和亞鐵離子等,同時鐵也與酸性廢液中的酸反應生成氫氣,涉及的離子方程式為Cu2++Fe=Cu+Fe2+、Fe+2Fe3+=3Fe2+、Fe+2H+=Fe2++H2↑,故答案為:Cu2++Fe=Cu+Fe2+、Fe+2Fe3+=3Fe2+或Fe+2H+=Fe2++H2↑;
(2)步驟②中從溶液中分離出固體物質過量的鐵和生成的銅,所以步驟②的操作名稱是過濾、洗滌,故答案為:過濾、洗滌;
(3)步驟④中為調節溶液的pH值,要能與酸反應同時不引入新的雜質,所以物質X為CuO或Cu (OH)2或CuCO3等,故答案為:CuO或Cu (OH)2或CuCO3等;
(4)步驟⑤的操作是從氯化銅溶液中獲得氯化銅晶體,要防止銅離子水解,所以步驟⑤的操作是在HCl氣流中蒸發結晶,故答案為:在HCl氣流中蒸發結晶;
(5)CuCl微溶于水、不溶于乙醇及稀硫酸,所以要用乙醇洗滌CuCl晶體,減少CuCl的損失,故答案為:減少CuCl的損失;
(6)根據流程分析可知,硫酸可以循環利用,Cu與濃硫酸反應生成CuSO4和 SO2的物質的量為1:1,而生產CuCl的過程中消耗CuSO4和SO2的物質的量也為1﹕1,所以理論上不需要補充H2SO4,故答案為:硫酸;否;Cu與濃硫酸反應生成CuSO4和 SO2的物質的量為1:1,而生產CuCl的過程中消耗CuSO4和SO2的物質的量也為1﹕1,所以理論上不需要補充H2SO4;(7)電解CuCl2溶液,陰極上是銅離子得電子生成亞銅離子,亞銅離子結合氯離子生成氯化亞銅沉淀,電極反應式為 Cu2++Cl-+e-=CuCl↓,
故答案為:Cu2++Cl-+e-=CuCl↓.


 智慧課堂密卷100分單元過關檢測系列答案
智慧課堂密卷100分單元過關檢測系列答案 單元期中期末卷系列答案
單元期中期末卷系列答案科目:高中化學 來源: 題型:
【題目】反應4A(g)+5B(g)═4C(g)+4D(g)在0.5L密閉容器中進行,30s后A減少了0.90mol,則此反應的速率可表示為( )
A.v(A)=0.030 mol/(Ls)
B.v(B)=0.075 mol/(Ls)
C.v(C)=0.030 mol/(Ls)
D.v(D)=0.030 mol/(Ls)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】決定氣體的體積的主要因素有( )
①氣體的分子個數 ②氣體分子的大小 ③氣體分子間的平均距離 ④氣體分子的相對分子質量
A. ①② B. ①③ C. ②③ D. ②④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關說法中正確的是 ( )
A. 淀粉是糖類物質,有甜味
B. 可用植物油萃取溴水中的溴單質
C. 乙酸可被酸性KMnO4溶液氧化
D. 在加熱條件下,可用銀氨溶液鑒別葡萄糖和蔗糖
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,向一容積為5 L的恒容密閉容器中充入0.4 mol SO2和0.2 mol O2,發生反應:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196 kJ/mol。當反應達到平衡時,容器內壓強變為起始時的0.7倍。請回答下列問題:
2SO3(g) ΔH=-196 kJ/mol。當反應達到平衡時,容器內壓強變為起始時的0.7倍。請回答下列問題:
(1 )判斷該反應達到平衡狀態的標志是___________(填字母)。
A.SO2、O2、SO3三者的濃度之比為2∶1∶2 B.容器內氣體的壓強不變
C.容器內混合氣體的密度保持不變 D.SO3的物質的量不再變化
E.SO2的生成速率和SO3的生成速率相等
(2)①SO2的轉化率=_______________;②達到平衡時反應放出的熱量為____________kJ;③此溫度下該反應的平衡常數K=__________。
(3)右圖表示平衡時SO2的體積分數隨壓強和溫度變化的曲線,則:

①溫度關系:T1________T2(填“>”、“<”或“=”,下同);
②平衡常數關系:KA_________KB,KA_________KD。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以烴A和芳香烴D為原料合成化合物X的路線如圖所示:

回答下列問題:
(1)A中含有官能團的名稱是_______,F的名稱是__________。
(2)E生成F的反應類型是___________。
(3)反應C+F→G的化學方程式為_______________________________。
(4)反應F→H的化學方程式為_________________________________。
(5)X的結構簡式為________________,下列有關X的說法不正確的是________(填字母)
a.能發生水解反應 b.能發生銀鏡反應
c.不能使溴的四氯化碳溶液褪色 d.能與濃硝酸發生取代反應
⑹芳香族化合物M是G的同分異構體,M能與NaHCO3溶液反應產生氣體,符合條
件的M有_____種,其中核磁共振氫譜有4組峰且峰面積之比為6:2:1:1的是______或______(填結構簡式)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com