
| 電離能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 共價鍵 | C-C | C-N | C-S |
| 鍵能/kJ•mol-1 | 347 | 305 | 259 |

| 離子晶體 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
分析 (1)根據同周期元素的電離能判斷元素的種類,A的I4電離能突然增大,說明最外層有3個電子,B的I3電離能突然增大,說明最外層有2個電子;
(2)根據紫外光的光子所具有的能量與蛋白質分子中重要化學鍵斷裂所需能量比較分析;最簡單的氨基酸為甘氨酸;
(3)離子晶體中晶格能越大,形成的離子晶體越穩定,熔點越高硬度越大,晶格能與離子的半徑、電荷有關,電荷越多、離子半徑越小,晶格能越大;根據結構的相似性判斷一個Mg2+周圍和它最鄰近且等距離的Mg2+個數;
(4)金屬陽離子含未成對電子越多,則磁性越大,根據離子的最外層電子數判斷未成對電子;
(5)該配合物中存在的化學鍵有:非金屬元素之間的共價鍵,鎳元素與氮元素之間的配位鍵,氧原子和氫原子之間的氫鍵.
解答 解:(1)A的I4電離能突然增大,說明最外層有3個電子,又A為第三周期元素,則A應為Al,B的I3電離能突然增大,說明最外層有2個電子,又B為第三周期元素,則B應為Mg,Al的正化合價為+3價,Mg的核外有12個電子,分三層排布,其電子排布式為:1s22s22p63s2;
故答案為:+3;1s22s22p63s2;
(2)波長為300nm的紫外光的光子所具有的能量約為399kJ/mol,比蛋白質分子中C-C、C-N和C-S的鍵能都大,所以波長為300nm的紫外光的光子能破壞蛋白質分子中的化學鍵,從而破壞蛋白質分子;最簡單的氨基酸為甘氨酸,甘氨酸中羧基中碳原子為 sp2 雜化,另一個碳原子為 sp3 雜化,
故答案為:紫外光具有的能量比蛋白質分子中重要的化學鍵C-C、C-N和C-S的鍵能都大,紫外光的能量足以使這些化學鍵斷裂,從而破壞蛋白質分子;sp2和sp3;
(3)離子晶體中晶格能越大,形成的離子晶體越穩定,熔點越高硬度越大,晶格能與離子的半徑、電荷有關,電荷越多、離子半徑越小,晶格能越大,TiN中陰陽離子所帶電荷為3,大于其它離子所帶電荷,MgO、CaO中所帶電荷相同,但鎂離子半徑小于鈣離子半徑,氯化鉀中陰陽離子所帶電荷為1,且鉀離子半徑>鈣離子半徑,氯離子半徑大于氧離子半徑,所以KCl、MgO、CaO、TiN4種離子晶體熔點從高到低的順序是TiN>MgO>CaO>KCl;
MgO的晶體結構與NaCl的晶體結構相似,所以一個Mg2+周圍和它最鄰近且等距離的Mg2+個數為12;
故答案為:TiN>MgO>CaO>KCl;12;
(4)V2O5中V的最外層電子全部失去或成鍵,CrO2中Cr失去4個電子,離子的最外層電子為2,為成對,離子含未成對電子越多,則磁性越大,則適合作錄音帶磁粉原料的是CrO2,
故答案為:CrO2;
(5)該配合物中存在的化學鍵有:非金屬元素之間的共價鍵,鎳元素與氮元素之間的配位鍵,氧原子和氫原子之間的氫鍵,故選AC;
故答案為:AC.
點評 本題考查了化合價和電負性的判斷、化學鍵、核外電子排布式的書寫等知識點,難度較大,注意(3)晶體的結構,注意晶格能與離子晶體熔點的關系,題目難度中等.


科目:高中化學 來源: 題型:選擇題
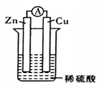
| A. | 溶液中的陽離子向正極移動,陰離子向負極移動 | |
| B. | 經過一段時問工作后'電解液的pH值減小 | |
| C. | 鋅片是正極,銅片上有氣泡產生 | |
| D. | 電流方向是從鋅片流向銅片 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 第3周期ⅡB族 | B. | 第4周期ⅡB族 | C. | 第4周期ⅦB族 | D. | 第4周期Ⅷ族 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
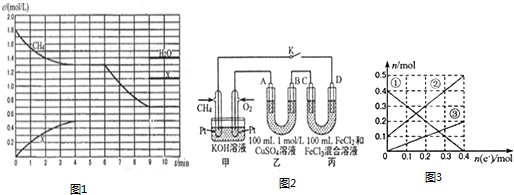
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 化學鍵 | H-H | C-O | C≡O | H-O | C-H |
| 鍵能/kJ.mol-1 | a | b | x | c | d |
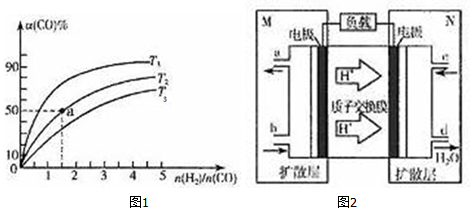
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
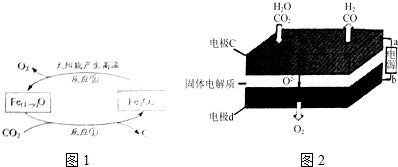
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| t℃ | 400 | 500 | 800 | 1000 |
| K | 2.6 | 1.6 | 1.0 | 0.40 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com