SnCl
4的制備需分兩步進行,第一步是金屬Sn的制備,第二步由Sn和Cl
2反應生成SnCl
4.
第一步:金屬Sn的制備--以錫石SnO
2為原料,用足量的焦炭作還原劑,在高溫下可制得粗錫,該反應的化學方程式為:
,粗錫經電解精煉可得純錫,精煉時的陰極反應式為
Sn2++2e-=Sn
Sn2++2e-=Sn
.
第二步:SnCl
4的制備--用干燥、純凈的Cl
2與熔融的Sn反應制SnCl
4,同時放出大量的熱.已知SnCl
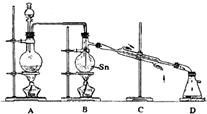
4常溫下是無色液體,沸點114℃,遇潮濕空氣便發生水解反應,Sn的熔點:231℃,右圖是制取SnCl
4的實驗裝置.
試回答以下問題:
(1)裝置A中反應的化學方程式為
MnO
2+4HCl(濃)
MnCl
2+Cl
2↑+2H
2O
MnO
2+4HCl(濃)
MnCl
2+Cl
2↑+2H
2O
;
(2)當反應生成SnCl
4時,應熄滅
B
B
處的酒精燈,理由是
依靠反應放出的熱量維持Sn的熔化
依靠反應放出的熱量維持Sn的熔化
;
(3)裝置B的主要缺點是
缺少溫度計
缺少溫度計
,裝置D的主要缺點是
裝置D后應連接一個裝有堿石灰的干燥管
裝置D后應連接一個裝有堿石灰的干燥管
;
(4)即使裝置B和裝置D進行改進后,老師說該實驗裝置設計仍不完整,請你協助該研究小組設計出所缺裝置(須標出試劑的名稱)并在下邊方框中畫出.


 SnCl4的制備需分兩步進行,第一步是金屬Sn的制備,第二步由Sn和Cl2反應生成SnCl4.
SnCl4的制備需分兩步進行,第一步是金屬Sn的制備,第二步由Sn和Cl2反應生成SnCl4.
 .
.

 華東師大版一課一練系列答案
華東師大版一課一練系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案
 SnCl4的制備需分兩步進行,第一步是金屬Sn的制備,第二步由Sn和Cl2反應生成SnCl4.
SnCl4的制備需分兩步進行,第一步是金屬Sn的制備,第二步由Sn和Cl2反應生成SnCl4.