
在加熱情況下,用足量CO還原7 g鐵的氧化物組成的混合物,產生氣體全部通入足量石灰水中得到12.5 g沉淀,此混合物不可能為:
A.FeO、Fe2O3 B.FeO、Fe3O4
C.Fe2O3、Fe3O4 D.FeO、Fe2O3、Fe3O4
B
【解析】
試題分析:生成的氣體是CO2,所以得到的沉淀是碳酸鈣,物質的量是0.125mol,則關鍵原子守恒可知,氧化物中氧元素的質量是0.125mol×16g/mol=2g,則鐵元素的質量是7g-2g=5g,所以氧化物中鐵原子和氧原子的原子個數之比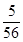 ︰
︰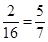 ,即該化合物的平均組成是Fe5O7。A中FeO、Fe2O3 的物質的量滿足1︰2即可;C中Fe2O3、Fe3O4的物質的量滿足1︰1即可;D中FeO、Fe2O3、Fe3O4的物質的量滿足1︰3︰1即可,所以答案選B。
,即該化合物的平均組成是Fe5O7。A中FeO、Fe2O3 的物質的量滿足1︰2即可;C中Fe2O3、Fe3O4的物質的量滿足1︰1即可;D中FeO、Fe2O3、Fe3O4的物質的量滿足1︰3︰1即可,所以答案選B。
考點:考查鐵的氧化物組成的有關計算和判斷
點評:該題是難度較大的計算題,對學生的綜合能力要求高。該題的難點不在于計算氧化物的平均組成,而在于通過平均組成進行的討論和排除。本題學生不易得分。


科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
有機物的C、H含量常用燃燒和與CuO灼燒等方法使之生成![]() 和水,測它們的質量求得有機物中碳和氫的百分含量,現有某固態有機物在加熱情況下鼓入足量的氧氣使其完全燃燒,今有如下儀器。
和水,測它們的質量求得有機物中碳和氫的百分含量,現有某固態有機物在加熱情況下鼓入足量的氧氣使其完全燃燒,今有如下儀器。
(1)為確定某固體有機物的最簡式(實驗式)下述儀器中最少需要的種類有________種,它們是________,其中要一前一后用兩次的是________,(填儀器編號)其作用前者為________;后者為________。但為完成測定還缺少的一種重要儀器名稱是________。
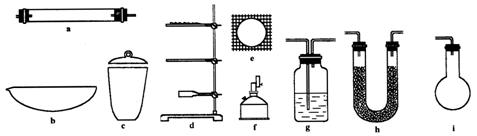
(2)為確定固體有機物是烴還是其含氧衍生物,實驗依據是________.
(3)為確定其分子式還需知道下述中的
A. 熔、沸點 B. 定溫、定壓下蒸氣密度
C. 固定有機物的體積 D. 重要的化學性質
查看答案和解析>>
科目:高中化學 來源:2013-2014學年上海市虹口區高三上學期期末考試(一模)化學試卷(解析版) 題型:計算題
膽礬晶體是硫酸銅的結晶水合物,其化學式為CuSO4•5H2O。在加熱情況下,按溫度不同,膽礬晶體會歷經一系列的變化,得到不同組成的固體。
(1)稱取0.1000 g含有雜質的膽礬試樣于錐形瓶中,加入0.1000 mol/L氫氧化鈉溶液28.00 mL,反應完全后,過量的氫氧化鈉用0.1000 mol/L硫酸滴定到終點,消耗硫酸10.08 mL,則試樣中膽礬的質量分數為___________。
(已知:CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4;試樣中的雜質不與酸、堿反應)
(2)將1.250 g 純凈的膽礬晶體置于坩堝中加熱一段時間,測得剩余固體質量為0.960 g。剩余固體中結晶水的質量分數為__________(保留三位小數)。
(3)將無水硫酸銅加熱至650℃以上,可得到黑色的氧化銅與三氧化硫、二氧化硫和氧氣的混合氣體。現將9.600 g無水硫酸銅充分加熱分解為氧化銅,將生成的氣體通過足量的吸收劑(堿石灰),吸收劑增重4.416 g。計算最終吸收劑中硫酸鹽與亞硫酸鹽的物質的量之比。
(4)無水硫酸銅受熱分解成氧化銅之前,有一種黃色中間產物X出現,其化學式可以表示為CuaOb(SO4)c(a、b、c為整數)。將X放入水中,有不溶的藍色沉淀Y生成(化學式為CuSO4·nCu(OH)2),同時還有2/3的硫酸根溶于水。若對Y進行加熱脫水,將失去11.9%的質量。已知X和Y均可溶于稀硫酸。通過計算確定X和Y的化學式。
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com