
【題目】X、Y、Z、M、W為五種短周期元素,X、Y、Z是原子序數依次遞增的同周期元素,且最外層電子數之和為15,X與Z可形成XZ2分子;丫與M形成的氣態化合物在標準狀況下的密度為0.76g·L-1; W的質子數是X、Y、Z、M四種元素質子數之和的![]() ,下列說法正確的是
,下列說法正確的是
A. 原子半徑:W>Z>Y>X>M
B. YZ2溶于水形成的溶液具有較強的氧化性
C. 由X、Y、Z、M四種元素形成的化合物一定既有離子鍵,又有共價鍵
D. 1 molWM溶于足量水中完全反應共轉移2mol電子
【答案】B
【解析】Y與M形成的氣態化合物在標準狀況下的密度為0.76g/L ,則該氣體的相對分子質量為0.76×22.4=17,則該氣體為NH3。結合X、Y、Z是原子序數依次遞增的同周期元素,且最外層電子數之和為15,X與Z可形成XZ2分子,可推出X是C,Y是N,Z是O,M是H。W的質子數是X、Y、Z、M四種元素質子數之和的1/2。則W是Na。A、同一周期的元素,原子序數越小,原子半徑越大;不同周期的元素,原子的電子層數越多,原子半徑越大。所以這幾種元素的原子半徑大小關系為原子半徑:Na>C>N>O>H,A錯誤;B、二氧化氮溶于水生成NO和硝酸,硝酸具有強氧化性,B正確;C、由X、Y、Z、M四種元素形成的化合物CO(NH2)2中只有共價鍵,沒有離子鍵,C錯誤;D、NaH與水反應的方程式為NaH+H2O=NaOH+H2↑,因此1molWM溶于足量水中完全反應共轉移1mol電子,D錯誤;答案選B。


科目:高中化學 來源: 題型:
【題目】亞氯酸鈉(NaClO2)是一種重要的消毒劑,主要用于水、砂糖、油脂的漂白與殺菌。以下是制取亞氯酸鈉的工藝流程:
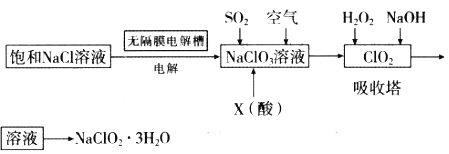
已知:①NaClO2的溶解度隨著溫度升高而增大,適當條件下可結晶析出。
②ClO2氣體在中性和堿性溶液中不能穩定存在。
回答下列問題:
(1)用于電解的食鹽水需先除去其中的Ca2+、Mg2+、SO42-等雜質。除雜操作時,往粗鹽水中先加入過量的_________(填化學式),至沉淀不再產生后。再加入過里的Na2CO3和NaOH,充分反應后將沉淀一并濾去。在無隔膜電解槽中用惰性電極電解一段時間生成NaClO3,陽極反應式為_______
(2)X酸是_________。寫出二氧化氯發生器中生成ClO2的化學方程式_______,吸收塔內的溫度不宜過高的原因為________
(3)亞氯酸鈉在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2有毒,經測定,25℃時各組分含量隨pH變化情況如圖所示(Cl-沒有畫出)。則下列分析正確的是(_____)
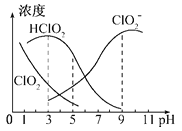
A.亞氯酸鈉在堿性條件下較穩定
B.25℃時,HClO2的濃度隨PH增大而增大
C.PH=6時,溶液中含氯微粒的濃度大小為:c(HClO2)>c(ClO2-)>c(ClO2)>c(Cl-)
D. 25℃時,該溶液在pH=4時比pH=2時更適合漂白
(4)aKg 30%的雙氧水理論上可最多制得___Kg NaClO2·3H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值,下列敘述正確的是( )
A.1 L 0.1 mol·L-1的CuCl2溶液中含Cu2+為0.1NA
B.標準狀況下,22.4 L CCl4含CCl4分子為NA
C.1mol H3O+含質子數為10 NA
D.1molNa2O和Na2O2混合物中含陰離子的總數為NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上有一種用CO2來生產甲醇燃料的方法:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g); ΔH=-49.0kJ/mol。某溫度下,將6molCO2和8molH2充入2L的密閉容器中,測得H2的物質的量隨時間變化如圖實線所示(實線)。圖中數據a(1,6)表示:在1min時H2的物質的量是6mol。
CH3OH(g)+H2O(g); ΔH=-49.0kJ/mol。某溫度下,將6molCO2和8molH2充入2L的密閉容器中,測得H2的物質的量隨時間變化如圖實線所示(實線)。圖中數據a(1,6)表示:在1min時H2的物質的量是6mol。
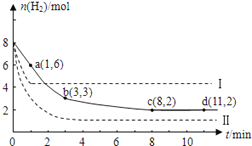
(1)第一分鐘內H2的平均反應速率是________列式并計算該溫度下的化學平衡常數K=______
(2)下列時間段平均反應速率最大的是_______
A.0-1min B.1-3min C.3-8min D.8-11min
(3)僅改變某一實驗條件再進行兩次實驗測得H2的物質的量隨時間變化如圖中虛線所示。曲線I對應的實驗條件改變是__________,曲線Ⅱ對應的實驗條件改變的是_____________。
(4)若在d點時向體系內充入2molCO2和2molH2O,此時V正_____V逆(大于,小于,等于)
(5)已知:
①CO(g)+1/2O2(g)=CO2(g); ΔH1=-283.0kJ/mol
②H2(g)+1/2O2(g)=H2O(g); ΔH2=-241.8kJ/mol
③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g); ΔH3=-192.2kJ/mol
在工業上常用CO和H2合成甲醇,該反應的熱方程式為_____________
(6)如圖是甲醇燃料電池原理示意圖,回答下列問題:電池負極的電極反應是:__________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1.
納米級Cu2O由于具有優良的催化性能而備受關注,下表為制取納米級Cu2O的三種方法:
窗體頂端
方法Ⅰ | 用炭粉在高溫條件下還原CuO |
方法Ⅱ | 電解法,反應為2Cu+H2O |
方法Ⅲ | 用肼(N2H4)還原新制Cu(OH)2 |
(1)工業上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是反應條件不易控制,若控溫不當易生成________而使Cu2O產率降低。
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H =-akJ·mol-1
C(s)+1/2O2(g)=CO(g) △H =-bkJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H =-ckJ·mol-1
則方法Ⅰ發生的反應:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H =_____。
(3)方法Ⅱ采用離子交換膜控制電解液中OH-的濃度而制備納米Cu2O,電解裝置如下圖所示。

①陰極上的產物是________ 。
②陽極生成Cu2O,其電極反應式為_________。
(4)方法Ⅲ為加熱條件下用液態肼(N2H4)還原新制Cu(OH)2來制備納米級Cu2O,同時放出N2,該反應的化學方程式為____________。
(5)肼又稱聯氨,易溶于水,是與氨類似的弱堿,用電離方程式表示肼的水溶液顯堿性的原因______。
(6)向1L恒容密閉容器中充入0.1molN2H4,在30℃、Ni-Pt催化劑作用下發生反應N2H4(g)![]() N2(g)+2H2(g),測得混合物體系中,
N2(g)+2H2(g),測得混合物體系中,![]() (用y表示)與時間的關系如圖所示。0-4min時間內H2的平均生成速率v(H2)=____mol/(L·min);該溫度下,反應的平衡常數=_______。
(用y表示)與時間的關系如圖所示。0-4min時間內H2的平均生成速率v(H2)=____mol/(L·min);該溫度下,反應的平衡常數=_______。

(7)肼-空氣清潔燃料電池是一種堿性燃料電池,電解質溶液時20%-30%的KOH溶液。肼-空氣燃料電池放電時,負極的電極反應式是_________。電池工作一點時間后,電解質溶液的pH將_______(填“增大”、“減小”、“不變”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氧化鈰(CeO2)是一種重要的稀土氧化物,平板電視顯示屏生產過程中產生大量的廢玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物質)。某課題組以此粉末為原料,設計如下工藝流程對資源進行回收,得到純凈的CeO2和硫酸鐵銨晶體。
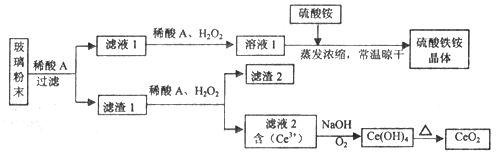
已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
(1)稀酸A的分子式是_____________________。
(2)濾液1中加入H2O2溶液的目的是__________________。
(3)設計實驗證明濾液1中含有Fe2+_____________________。
(4)已知Fe2+溶液可以和難溶于水的FeO(OH)反應生成Fe3O4,書寫該反應的離子方程式____________。
(5)由濾液2生成Ce(OH)4的離子方程式__________________。
(6)硫酸鐵銨晶體[Fe2(SO4)3·2(NH4)2SO4·3H2O]廣泛用于水的凈化處理,但其在去除酸性廢水中的懸浮物時效率降低,其原因是___________________。
(7)取上述流程中得到的Ce(OH)4產品0.531 g,加硫酸溶解后,用濃度為0.l000mol·L-1FeSO 4標準溶液滴定至終點時(鈰被還原為Ce3+ ),消耗25.00 mL標準溶液。該產品中Ce(OH)4的質置分數為_______(結果保留兩位有效數字)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中藥狼把草的成分之一M具有消炎殺菌作用,M的結構如圖所示。下列敘述正確的是( )

A.M的相對分子質量是180
B.1 mol M最多能與2 mol Br2發生反應
C.M與足量的NaOH溶液發生反應時,所得有機產物的化學式為C9H4O5Na4
D.1 mol M與足量H2反應,最多消耗5 mol H2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】生產、生活中常設計化學知識,下列說法正確的是
A. “海市蜃樓”現象是膠體的丁達爾效應造成的
B. 明礬可用于再來水的凈化和消毒
C. 在香蕉箱中放入浸有KMnO4溶液的硅藻土可延長保鮮期
D. 由于碘單質受熱易升華,所以炒菜時加碘鹽最后放
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知0.1mol/L的醋酸溶液中存在電離平衡:CH3COOH![]() CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是 ( )
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是 ( )
A.加少量燒堿固體 B.加少量CH3COONa固體
C.加少量冰醋酸 D.加水
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com