
【題目】下列實驗操作中,正確的是( )
A. 向試管中滴加試劑時,將滴管下端緊靠試管內壁
B. 不能用燃著的酒精燈去點燃另一酒精燈
C. 使用試紙檢驗溶液的性質時,將試紙浸入溶液中
D. 加完藥品后應將滴管洗凈后再放回原瓶
 全程金卷系列答案
全程金卷系列答案科目:高中化學 來源: 題型:
【題目】A是由導熱材料制成的密閉容器,B是一耐化學腐蝕且易于傳熱的氣球。關閉K2,將等量且少量的NO2通過K1、K3分別充入A、B中,反應起始時,A、B的體積相同。(已知:2NO2![]() N2O4
N2O4![]() )
)
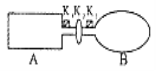
(1)一段時間后,反應達到平衡,此時A、B中生成的N2O4的速率是v(A)________(填“>”、“<”、“=”)v(B);若打開活塞K2,氣球B將________(填“增大”、“減小”、“不變”)。
(2)若平衡后在A、B中再充入與初始量相等的NO2,則達到平衡時,A中的NO2轉化率________,B中的NO2轉化率將________(填“增大”、“減小”、“不變”);若通入等量的Ne氣,則達到平衡時,A中的NO2轉化率________,B中的NO2轉化率將________(填“增大”、“減小”、“不變”)。
(3)室溫下,若A、B都保持體積不變,將A套上—個絕熱層,B與外界可以進行熱傳遞,則達到平衡時,____________中的顏色較深。
(4)若在容器A中充入4.6g的NO2,達到平衡后容器內混合氣體的平均相對分子質量為57.5,則平衡時的N2O4物質的量為_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】把VL含有MgSO4和K2SO4的混合溶液分成兩等份,一份加入含amolNaOH的溶液,恰好使鎂離子完全沉淀為氫氧化鎂;另一份加入含bmolBaCl2的溶液,恰好使硫酸根離子完全沉淀為硫酸鋇。則原混合溶液中鉀離子的濃度為( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某強堿性溶液中可能含有的離子是K+、NH![]() 、Al3+、AlO
、Al3+、AlO![]() 、SO
、SO![]() 、SiO
、SiO![]() 、CO
、CO![]() 、Cl-中的某幾種離子,現進行如下實驗:
、Cl-中的某幾種離子,現進行如下實驗:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,無沉淀生成;
②另取少量溶液加入鹽酸,其現象是:一段時間保持原樣后,開始產生沉淀并逐漸增多,沉淀量基本不變后產生一種氣體,最后沉淀逐漸減少至消失。
(1)原溶液中肯定存在的離子是,肯定不存在的離子是。
(2)已知一定量的原溶液中加入5mL0.2mol/L鹽酸時,沉淀會完全消失,加入足量的硝酸銀溶液可得到沉淀0.187g,則原溶液中是否含有Cl- ?。
(3)按照反應順序逐步書寫出②中發生反應的離子反應方程式
①H++OH-=H2O②
③
④HCO3-+H+=H2O+CO2↑
⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知由短周期常見元素形成的純凈物A、B、C、D轉化關系如圖1瑣事,物質A與物質B之間的反應不再溶液中進行。

若A為金屬單質,C是淡黃色固體,D是一元強堿。
①物質B是__________(填化學式)。
②化合物C的電子式為_________;化合物D中所含化學鍵的類型是_________。
③在常溫下,向PH=a的醋酸溶液中加入等體積pH=b的D溶液,且a+b=14,則充分反應后,所得溶液中各種離子的濃度由大到小的順序是:__________.
(2)若A為非金屬單質,C是有色氣體,D是一元強酸.
①B為__________(填化學式)。
②化合物C與H2O反應化學方程式___________,氧化劑與還原劑的量比為_________。
(3)某同學用圖2裝置完成有關探究實驗。
Ⅰ試管中發生反應的離子方程式為__________。
Ⅱ試管中觀察到__________的實驗現象時,說明NO2能溶于濃硫酸中,濃硫酸不能干燥NO2。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用0.10mol·L-1的鹽酸滴定0.10mol·L-1的氨水,滴定過程中不可能出現的結果是
A.c(NH![]() )>c(Cl-),c(OH-)>c(H+)
)>c(Cl-),c(OH-)>c(H+)
B.c(NH![]() )=c(Cl-),c(OH-)=c(H+)
)=c(Cl-),c(OH-)=c(H+)
C.c(Cl-)>c(NH![]() ),c(OH-)>c(H+)
),c(OH-)>c(H+)
D.c(Cl-)>c(NH![]() ),c(H+)>c(OH-)
),c(H+)>c(OH-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】【2017屆天津市五區縣上學期期末聯考】下列有關物質的性質與用途說法不正確的是
A.FeCl3易溶于水,可用作凈水劑
B.硅是半導體材料,純凈的硅是光纖制品的基本原料
C.濃硫酸能干燥氯氣,說明濃硫酸具有吸水性
D.氨易液化,液氨氣化吸收大量的熱,所以液氨常用作制冷劑
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com