
【題目】某學生用0.2000mol·L-1的標準NaOH溶液滴定未知濃度的鹽酸,其操作如下:
![]()
① 用蒸餾水洗滌堿式滴定管,并立即注入NaOH溶液至“0”刻度線以上;
② 固定好滴定管并使滴定管尖嘴充滿液體;
③ 調節液面至“0”或“0”刻度線稍下,并記下讀數;
④ 移取20.00mL待測液注入潔凈的錐形瓶中,并加入3滴酚酞溶液;
⑤ 用標準液滴定至終點,記下滴定管液面讀數。
請回答:
(1)以上步驟有誤的是(填編號)____,若測定結果偏高,其原因可能是______.
A.配制標準溶液的固體NaOH中混有KOH雜質
B.滴定終點讀數時,仰視滴定管的刻度,其他操作正確
C.盛裝未知液的錐形瓶用蒸餾水洗過后再用未知液潤洗
D.滴定到終點讀數時,發現滴定管尖嘴處懸掛一滴溶液
(2)判斷滴定終點的現象是____________________________。
(3)如下圖是某次滴定時的滴定管中的液面,其讀數為________mL。
(4)根據下列數據:請計算待測鹽酸溶液的濃度______mol/L。
滴定次數 | 待測體積(mL) | 標準燒堿體積(mL) | |
滴定前讀數 | 滴定后讀數 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |
【答案】 ① AD 滴入最后一滴氫氧化鈉溶液,溶液由無色變為淺紅色,且保持30秒不褪色 22.60 0.2000
【解析】(1)堿式滴定管應該是先用蒸餾水潤洗,然后用標準NaOH溶液潤洗,否則會影響標準液的濃度,故第①步錯誤;配制標準溶液的固體NaOH中混有KOH雜質,標準溶液中氫氧根離子的濃度偏小,消耗的V(標準)增大,根據![]() ,測定結果偏高,所以A選項是正確的;滴定終點讀數時,仰視滴定管的刻度,消耗的V(標準)偏小,據
,測定結果偏高,所以A選項是正確的;滴定終點讀數時,仰視滴定管的刻度,消耗的V(標準)偏小,據![]() 分析,測定結果偏低,所以B錯誤;盛裝未知液的錐形瓶用蒸餾水洗過后再用未知液潤洗,消耗的V(標準)不變,
分析,測定結果偏低,所以B錯誤;盛裝未知液的錐形瓶用蒸餾水洗過后再用未知液潤洗,消耗的V(標準)不變,![]() 分析,測定結果不變,故C錯誤;滴定到終點讀數時,發現滴定管尖嘴處懸掛一滴溶液,消耗的V(標準)偏大,
分析,測定結果不變,故C錯誤;滴定到終點讀數時,發現滴定管尖嘴處懸掛一滴溶液,消耗的V(標準)偏大, ![]() 分析,測定結果偏高,所以D選項是正確的;正確選項.AD。
分析,測定結果偏高,所以D選項是正確的;正確選項.AD。
(2)滴定終點的現象是:當滴入最后一滴NaOH溶液時,錐形瓶中溶液由無色變為淺紅色,且保持30秒不消失;正確答案:滴入最后一滴氫氧化鈉溶液,溶液由無色變為淺紅色,保持30秒不消失。
(3)滴定管中的液面讀數為![]() ;正確答案:22.60。
;正確答案:22.60。
(4)三次滴定消耗的體積為20.00mL 、22.1 mL、20.00mL;第二組數據不能用,所以消耗氫氧化鈉的體積![]() ,根據
,根據![]() =0.2×20×10-3/20×10-3= 0.2000 mol/L;正確答案:0.2000。
=0.2×20×10-3/20×10-3= 0.2000 mol/L;正確答案:0.2000。


 第1卷單元月考期中期末系列答案
第1卷單元月考期中期末系列答案科目:高中化學 來源: 題型:
【題目】在常溫下,Fe與水并不發生反應,但在高溫下,Fe與水蒸氣可發生反應。高溫下Fe與水蒸氣的反應實驗應使用如圖所示的裝置,在硬質玻璃管中放入鐵粉和石棉絨的混合物,通入水蒸氣并加熱。請回答實驗的相關問題。
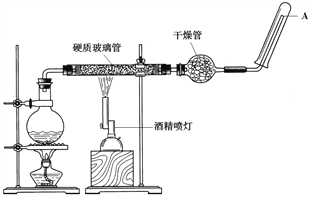
(1)該反應的反應方程式為_________。
(2)圓底燒瓶中裝的是水,該裝置的主要作用是______________;燒瓶底部放了幾片碎瓷片,碎瓷片的作用是________________________。
(3)干燥管中盛裝的物質是____________,作用是________________________。
(4)如果要在A處玻璃管口點燃該氣體,則必須對該氣體進行____________,方法是____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用一定量的鐵與足量的稀H2SO4及足量的CuO制單質銅,有人設計以下兩種方案:
①Fe ![]() H2
H2 ![]() Cu , ② CuO
Cu , ② CuO ![]() CuSO4
CuSO4 ![]() Cu 。
Cu 。
若實驗過程中,根據一般的實驗方法和實驗操作規則進行操作,則對兩者制得單質銅的量作比較,正確的是
A. 相等 B. ①多 C. ②多 D. 無法判斷
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸錳可用于飲料營養強氧化劑和媒染劑。其生產原材料軟錳礦(MnO2)、菱錳礦(MnCO3)中常混有硫酸亞鐵和硫酸鎂等雜質,生產工藝流程如圖所示:
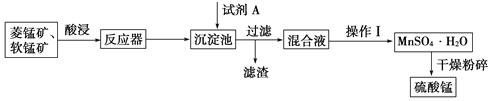
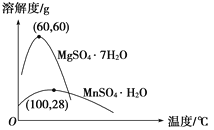
已知:(1)硫酸錳晶體和硫酸鎂晶體的溶解度曲線如圖所示。
(2)各離子完全沉淀的pH:Fe3+為3.5,Fe2+為9.5,Mn2+為10.8,Mg2+為11.6。下列判斷正確的是
A. 試劑A應該選擇H2O2,目的是將Fe2+氧化為Fe3+
B. 試劑A應該選擇氨水,目的是調節溶液的pH
C. 操作Ⅰ包括蒸發濃縮、冷卻結晶、趁熱過濾、洗滌等步驟,洗滌時可用稀硫酸作洗滌液
D. 通過操作Ⅰ得到MnSO4·H2O的過程中,包括蒸發結晶,在蒸發結晶時,溫度應該高于60 ℃
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NiSO4·6H2O是一種綠色易溶于水的晶體,可由電鍍廢渣(除鎳外,還含有銅、鋅、鐵等元素)為原料獲得。操作步驟如下:
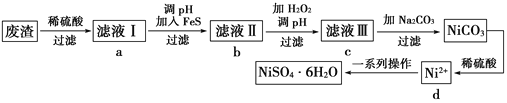
(1)向濾液Ⅰ中加入FeS是為了生成難溶于酸的硫化物沉淀而除去Cu2+、Zn2+等雜質,則除去Cu2+的離子方程式為___________________________________。
(2)對濾液Ⅱ的操作,請回答:
①往濾液Ⅱ中加入H2O2的離子方程式為________________________________。
②調濾液ⅡpH的目的是除去Fe3+,其原理是Fe3++3H2O![]() Fe(OH)3+3H+,已知25 ℃時Ksp[Fe(OH)3]=2.8×10-39,則該溫度下上述反應的平衡常數K=________________。
Fe(OH)3+3H+,已知25 ℃時Ksp[Fe(OH)3]=2.8×10-39,則該溫度下上述反應的平衡常數K=________________。
③檢驗Fe3+是否除盡的操作和現象是__________________________________________。
(3)濾液Ⅲ中溶質的主要成分是NiSO4,加Na2CO3過濾后得到NiCO3固體,再加適量稀硫酸溶解又生成NiSO4,這兩步操作的目的是___________________。
(4)得到的NiSO4溶液經蒸發濃縮、冷卻結晶、過濾等一系列操作可得到NiSO4·6H2O,請回答:
①在進行蒸發濃縮操作時,加熱到___________________________(描述實驗現象)時,則停止加熱。
②為了提高產率,過濾后得到的母液要循環使用,則應該回流到流程中的________位置(選填a、b、c、d)。
③如果得到產品的純度不夠,則應該進行________(填操作名稱)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,在20ml 0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1醋酸溶液,滴定曲線如圖所 示,有關粒子濃度的關系中,不正確的是( )

A. 在A點:c(Na+)﹥c(OH-)﹥c(CH3COO-)﹥c(H+)
B. 在B點:c(Na+) ﹦c(CH3COO-) ﹥c(OH-)﹦c(H+)
C. 在C點:c(CH3COO-)﹥c(Na+)﹥c(H+) ﹥c(OH-)
D. 在C點:c(CH3COO-)+c(CH3COOH)﹦2 c(Na+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在下右圖所示的裝置中,燒瓶中充滿干燥氣體a,將滴管中的液體b擠入燒瓶內,輕輕振蕩燒瓶,然后打開彈簧夾f,燒杯中的液體b呈噴泉狀噴出,最終幾乎充滿燒瓶。則a和b不滿足題目要求的是
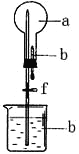
選項 | a(干燥氣體) | b(液體) |
A | Cl2 | 飽和NaOH溶液 |
B | SO2 | 4mol/LNaOH溶液 |
C | NO2 | 水 |
D | NH3 | 1mol/L鹽酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】堿性電池具有容量大、放電電流大的特點,因而得到廣泛應用.鋅﹣錳堿性電池以氫氧化鉀溶液為電解液,電池總反應式為:Zn(s)+2MnO2(s)+H2O(l)![]() Zn(OH)2(s)+Mn2O3(s) 下列說法錯誤的是( )
Zn(OH)2(s)+Mn2O3(s) 下列說法錯誤的是( )
A. 電池工作時,鋅失去電子
B. 電池正極的電極反應式為:2MnO2(s)+H2O(1)+2e﹣=Mn2O3(s)+2OH﹣(aq)
C. 電池工作時,電子由正極通過外電路流向負極
D. 外電路中每通過0.2mol電子,鋅的質量理論上減小6.5g
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com