
【題目】把鐵和氧化鐵組成的某混合物放入250 mL 2.0 mol·L-1的硝酸溶液中,充分反應后,生成的一氧化氮氣體在標準狀況下的體積為1.12 L,再向反應后的溶液中加入1.0 mol·L-1的氫氧化鈉溶液,要使鐵元素完全沉淀下來,加入的氫氧化鈉溶液的體積最少是
A.400 mLB.450 mLC.500 mLD.550 mL
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】下圖是實驗室干餾煤的裝置圖,結合下圖回答問題。
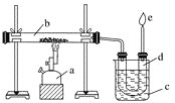
(1)指出圖中儀器名稱:a__________;b__________;c__________;d__________。
(2)裝置c的作用是____________________________________,d中的液體有________和________。有機物可以通過________的方法使其中的重要成分分離出來。
(3)e處點燃的氣體是________,火焰的顏色是________色。
(4)下列敘述錯誤的是________。
A.煤發生了化學變化
B.d中液體顯堿性
C.d中液體不分層
D.e處的氣體可以還原氧化銅,也可以使溴水褪色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】 MnO2是一種重要的無機功能材料,工業上提純粗MnO2(含有較多的MnO和MnCO3)實驗工藝流程如下圖,則下列說法不正確的是
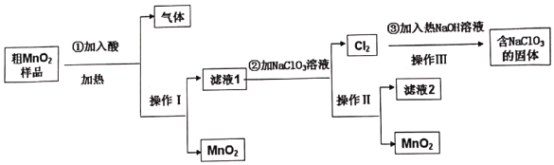
A.若①加入的是稀H2SO4,實際生產中可由濾液2進一步制得副產品Na2SO410H2O
B.操作Ⅲ是減壓蒸發,理論上得到的固體NaCl和NaClO3物質的量之比為5:1
C.①加酸的目的是溶解MnO和MnCO3,實際生產可以用濃鹽酸進行溶解
D.②反應的離子方程式:5Mn2++2ClO3-+4H2O=5MnO2↓+Cl2↑+8H+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】阿司匹林銅具有很強的抗炎作用。它是一種亮藍色結晶粉末,不溶于水、醇、醚及氯仿等溶劑中。易受熱分解成淺綠色混合物。在強酸條件下能解離出銅離子。合成阿司匹林銅,其實驗流程如下:
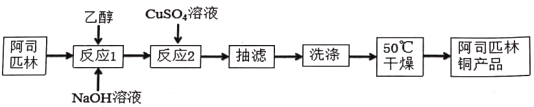
已知反應方程式如下:
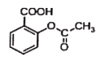 +NaOH→
+NaOH→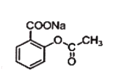 +H2O
+H2O
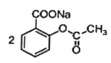 +CuSO4→
+CuSO4→ +Na2SO4
+Na2SO4
(1)下列有關說法正確的是_____。
A.反應1中加乙醇作溶劑,目的是增大接觸面積,加快反應速率
B.用傾析法將反應2中的液體和沉淀同時轉移到布氏漏斗中進行抽濾
C.洗滌操作中,可先用水洗2-3次,再用酒精洗滌2-3次
D.干燥后發現固體呈淺綠色,可能是烘干溫度過高造成的結果
(2)反應1中的反應溫度要求控制在室溫的理由是______。
(3)阿司匹林銅中銅含量的測定,可用碘量法測定:
步驟一:準確稱取0.800g樣品,置于250mL錐形瓶中,加4mL3.00mol/L,再加20mL水,加熱煮沸,樣品完全分解后,搖勻,冷卻到室溫。
步驟二:往溶液中加入1.200gKI搖勻,用0.100mol/LNa2S2O3標準溶液滴定至溶液變淺黃色時,加入10mL 10% KSCN試劑,并加幾滴淀粉溶液,繼續用0.100mol/LNa2S2O3標準溶液滴定至終點,共消耗溶液體積為23.00mL。
已知:CuI難溶于水,能吸附碘;I2+2S2O32-=S4O62-+2I-。
CuI(s)+SCN-(aq)![]() CuSCN(s)+I-(aq)
CuSCN(s)+I-(aq)
①實驗中加入10mL 10%KSCN試劑的目的是______。
②上述測定實驗中,繼續滴加Na2S2O3標準溶液至終點的具體實驗操作______。
③該樣品中的銅含量為______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定溫度下的定容密閉容器中,當下列條件不再改變時,表明反應:A(s)+2B(g) ![]() C(g)+D(g)已達到平衡狀態的是
C(g)+D(g)已達到平衡狀態的是
A. 混合氣體的壓強 B. 氣體的總物質的量
C. 混合氣體的密度 D. 單位時間內生成n molC的同時消耗2n molB
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】綠色化學、環境保護和人類健康是息息相關的三個主題,請根據已知信息回答有關問題:
(1)下列制備氯乙烷的反應中原子經濟性最高的是________(填序號)。
A.CH2=CH2+HCl→CH3CH2Cl
B.CH3CH2OH+HCl→CH3CH2Cl+H2O
C.CH3CH3+Cl2![]() CH3CH2Cl+HCl
CH3CH2Cl+HCl
D.CH2=CHCl+H2![]() CH3CH2Cl
CH3CH2Cl
由上述四個反應可歸納出,原子經濟性高的是________反應(填反應類型)。
(2)有毒物質的無害化也是綠色化學研究的內容之一。ClO2是一種性能優良的消毒劑,還可將廢水中少量的S2-、NO2-和CN-等有毒有害的還原性酸根離子氧化除去。請寫出用ClO2將廢水中有劇毒的CN-氧化成無毒氣體的離子方程式:____________________并說明該方法的優點:_____________________________________。
(3)如圖為某飲用水廠從天然水制備純凈水(去離子水)的工藝流程示意圖:
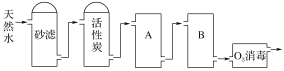
活性炭的作用是____________________;用O3消毒的優點是____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA代表阿伏加德羅常數的值。下列敘述正確的是( )
A.9g超重水(3H216O)含中子數為6NA
B.標準狀況下,22.4L CCl4含有的分子數目為NA
C.常溫常壓下,92g的NO2和N2O4混合氣體含有的原子數為6NA
D.一定條件下,將1mol N2和3mol H2混合,充分反應后轉移的電子數為6NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】過渡金屬元素如Fe、Mn、Cu、Ni可用作很多反應的催化劑,在室溫下以H2O2為氧化劑直接將CH4氧化,回答下列問題:
(1)基態銅原子的核外電子排布式是___,第四周期元素中,基態原子未成對電子數最多的元素是____(填元素符號)
(2)C、H、O、Fe四種元素的電負性由大到小的順序是____
(3)常溫下,H2O2氧化CH4生成CH3OH、HCHO等
①CH3OH和HCHO的沸點分別是64.7℃、-19.5℃,其主要原因是____
②CH4、HCHO的鍵角較大的是___,原因是______
(4)Cu2+可與乙二胺(NH2CH2CH2NH2,簡寫為en)形成配合物,化學式為Cu(en)22+,乙二胺中與Cu2+形成配位鍵的原子是___(填元素符號),該配合物的配位數是__
(5)Cu晶胞結構如圖所示,已知銅原子半徑為apm,阿伏加德羅常數用NA表示,則銅晶體的密度為____g/cm3(寫出計算表達式)

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學興趣小組設計以下實驗方案,測定某已部分變質的小蘇打樣品中碳酸鈉的質量分數。
[方案一]稱取一定質量樣品,置于坩堝中加熱至恒重后,冷卻,稱量剩余固體質量,計算。
(1)坩堝中發生反應的化學方程式為____________。
(2)實驗中,需加熱至恒重的目的是_____________。
[方案二]稱取一定質量樣品,置于小燒杯中,加適量水溶解;向小燒杯中加入足量氫氧化鋇溶液,過濾、洗滌、干燥沉淀,稱量固體質量,計算。(已知:Ba2++OH-+HCO3-=BaCO3↓+H2O)。
(1)過濾操作中,除了燒杯、漏斗外,還要用到的玻璃儀器為__________。
(2)實驗中判斷沉淀是否完全的方法是__________。
[方案三]按如下圖所示裝置進行實驗:
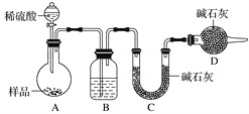
(1)D裝置的作用是________,分液漏斗中_____(填“能”或“不能”)用鹽酸代替稀硫酸進行實驗。
(2)實驗前稱取17.90g樣品,實驗后測得C裝置增重8.80g,則樣品中碳酸鈉的質量分數為________。
(3)根據此實驗測得的數據,測定結果有誤差,因為實驗裝置還存在一個明顯缺陷是_________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com