
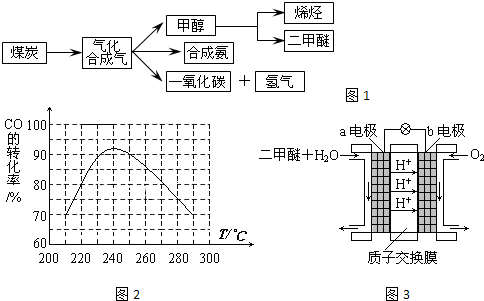
圖一是煤化工產業(yè)鏈的一部分,試運用所學知識,回答下列問題:
圖一
(1)圖一中氣體A的俗稱是_______________
(2)合成氨工業(yè)是煤化工產業(yè)鏈中非常重要的一步。已知有一組數(shù)據(jù):破壞1mol氮氣中的化學鍵需要吸收946 kJ能量;破壞0.5mol氫氣中的H-H鍵需要吸收218kJ的能量;形成氨分子中1 mol N-H鍵能夠釋放389kJ能量。圖二表示合成氨工業(yè)過程中能量的變化,請將圖中①、②的能量變化的數(shù)值,填在下邊的橫線上。 
圖二
① kJ ,② kJ
(3)煤化工產業(yè)的重要產品之一甲醇,是一種新型的汽車動力燃料,發(fā)達國家等一般通過CO和H2化合制備甲醇,該反應的化學方程式為:CO (g) + 2H2(g) CH3OH(g)
CH3OH(g)
①下列描述中能說明上述反應已達平衡的是_______;
A. 容器內氣體的平均摩爾質量保持不變
B. 2v(H2)正 = v(CH3OH)逆
C. 容器中氣體的壓強保持不變
D. 單位時間內生成n molCO的同時生成2n mol H2
②在容積固定的恒溫密閉容器中充入CO和H2發(fā)生上述反應,反應在第4 min時候達到其限度,此時容器中壓強與反應前之比為3︰5,容器內物質的各種物質的量濃度如下表:
| 時間/濃度 | c(CO)(mol/L) | C(H2 )(mol/L) | c(CH3OH)(mol/L) |
| 起始 | 0.200 | 0.300 | 0.000 |
| 第4 min | a | b | c |

(1)水煤氣 (2) ① 2254 ② 80 (3) A、C 0.100
(4)CH3OH-6e- +H2O=CO2+6H+ 增大
解析試題分析:(2)①吸收的能量=946+218×6= 2254KJ,②放出的能量=2254-2334=80KJ
(3)①該反應前后氣體分子總數(shù)不相等,故當平均相對摩爾質量、壓強不變時,反應達到了平衡狀態(tài);v(H2)正 = 2v(CH3OH)逆也能表示反應達到平衡狀態(tài),而D選項都表示逆反應,不能表示反應達到平衡狀態(tài)。②設反應過程中,CO的轉化濃度為x,H2為2x,甲醇為x。則CO的平衡濃度為(0.2-x),H2的平衡濃度為(0.3-2x),甲醇的平衡濃度為x,故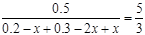 ,解得:x=0.100。(4)負極發(fā)生氧化反應,正極發(fā)生還原反應,正極的電極反應式:O2+4e-+4H+=2H2O,故正極的pH值增大。
,解得:x=0.100。(4)負極發(fā)生氧化反應,正極發(fā)生還原反應,正極的電極反應式:O2+4e-+4H+=2H2O,故正極的pH值增大。
考點:化學與化工生產
點評:化工生產是工業(yè)的重要產業(yè),近年來高考的熱點,考生在備考過程中應注意知識的靈活運用,達到舉一反三的效果。難度較大。


科目:高中化學 來源: 題型:閱讀理解

| [H2][CO] |
| [H2O] |
| 容器編號 | n(C)mol | n(H2O)mol | n(CO)mol | n(H2)mol | v正、v逆比較 |
| Ⅰ | 0.2 | 0.12 | 1.20 | 0.20 | v正=v逆 |
| Ⅱ | 0.16 | 0.20 | 0.40 | 0.80 | v正 > > v逆 |
| 0.2×0.4 |
| 0.1 |
| 0.2×0.4 |
| 0.1 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| C(H2)?C(CO) |
| C(H2O) |
| 高溫 |
| 高溫 |
| 高溫 |
查看答案和解析>>
科目:高中化學 來源:2015屆重慶一中高一下學期期末考試化學試卷(解析版) 題型:填空題
圖一是煤化工產業(yè)鏈的一部分,試運用所學知識,回答下列問題:

圖一
(1)圖一中氣體A的俗稱是_______________
(2)合成氨工業(yè)是煤化工產業(yè)鏈中非常重要的一步。已知有一組數(shù)據(jù):破壞1mol氮氣中的化學鍵需要吸收946 kJ能量;破壞0.5mol氫氣中的H-H鍵需要吸收218kJ的能量;形成氨分子中1 mol N-H鍵能夠釋放389kJ能量。圖二表示合成氨工業(yè)過程中能量的變化,請將圖中①、②的能量變化的數(shù)值,填在下邊的橫線上。

圖二
① kJ ,② kJ
(3)煤化工產業(yè)的重要產品之一甲醇,是一種新型的汽車動力燃料,發(fā)達國家等一般通過CO和H2化合制備甲醇,該反應的化學方程式為:CO (g) + 2H2(g) CH3OH(g)
CH3OH(g)
①下列描述中能說明上述反應已達平衡的是_______;
A. 容器內氣體的平均摩爾質量保持不變
B. 2v(H2)正 = v(CH3OH)逆
C. 容器中氣體的壓強保持不變
D. 單位時間內生成n molCO的同時生成2n mol H2
②在容積固定的恒溫密閉容器中充入CO和H2發(fā)生上述反應,反應在第4 min時候達到其限度,此時容器中壓強與反應前之比為3︰5,容器內物質的各種物質的量濃度如下表:
|
時間/濃度 |
c(CO)(mol/L) |
C(H2 )(mol/L) |
c(CH3OH)(mol/L) |
|
起始 |
0.200 |
0.300 |
0.000 |
|
第4 min |
a |
b |
c |
則b=__________________
(4)甲醇—空氣燃料電池(DMFC)是一種高效能、輕污染電動汽車的車載電池,其工作原理如下圖所示,該燃料電池的電池反應式為2CH3OH (g) + 3O2(g) =
2CO2(g) + 4H2O(l),則負極的電極反應式為______________________,正極附近pH值_______________(填寫“增大”、“減小”或者“不變”)
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
圖一是煤化工產業(yè)鏈的一部分,試運用所學知識,回答下列問題:

(1)圖一中氣體A的俗稱是_______________
(2)合成氨工業(yè)是煤化工產業(yè)鏈中非常重要的一步。已知有一組數(shù)據(jù):破壞1mol氮氣中的化學鍵需要吸收946 kJ能量;破壞0.5mol氫氣中的H-H鍵需要吸收218kJ的能量;形成氨分子中1 mol N-H鍵能夠釋放389kJ能量。圖二表示合成氨工業(yè)過程中能量的變化,請將圖中①、②的能量變化的數(shù)值,填在下邊的橫線上。
① kJ ,② kJ
(3)煤化工產業(yè)的重要產品之一甲醇,是一種新型的汽車動力燃料,發(fā)達國家等一般通過CO和H2化合制備甲醇,該反應的化學方程式為:CO (g) + 2H2(g)![]() CH3OH(g)
CH3OH(g)
①下列描述中能說明上述反應已達平衡的是_______;
A. 容器內氣體的平均摩爾質量保持不變
B. 2v(H2)正 = v(CH3OH)逆
C. 容器中氣體的壓強保持不變
D. 單位時間內生成n molCO的同時生成2n mol H2
②在容積固定的恒溫密閉容器中充入CO和H2發(fā)生上述反應,反應在第4 min時候達到其限度,此時容器中壓強與反應前之比為3︰5,容器內物質的各種物質的量濃度如下表:
| 時間/濃度 | c(CO)(mol/L) | c(H2 )(mol/L) | c(CH3OH)(mol/L) |
| 起始 | 0.200 | 0.300 | 0.000 |
| 第4 min | a | b | c |
則b=__________________
(4)甲醇—空氣燃料電池(DMFC)是一種高效能、輕污 染電動汽車的車載電池,其工作原理如下圖所示,該燃料電池的電池反應式為2CH3OH (g) + 3O2(g) = 2CO2(g) + 4H2O(l),則負極的電極反應式為______________________,正極附近pH值_______________(填寫“增大”、“減小”或者“不變”)

查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com