
【題目】課本里介紹的合成氨技術叫哈伯法,是德國諾貝爾化學獎獲得者哈伯發明的。其合成原理為:N2(g) + 3H2(g) ![]() 2NH3(g) △H<0,△S <0。
2NH3(g) △H<0,△S <0。
(1)下列關于工業合成氨的說法不正確的是_______
A.因為△H<0,所以該反應一定能自發進行
B.因為△S<0,所以該反應一定不能自發進行
C.在高溫下進行是為了提高反應物的轉化率
D.使用催化劑加快反應速率是因為催化劑降低了反應的△H
(2)在恒溫恒容密閉容器中進行合成氨的反應,下列能說明該反應已達到平衡狀態的是_______
a.容器內N2、H2、NH3的濃度之比為1:3:2 b.v正(N2)= v逆(H2)
c.容器內壓強保持不變 d.合氣體的密度保持不變
(3)某科研小組研究:在其他條件不變的情況下,改變起始物氫氣的物質的量對工業合成氨反應的影響。實驗結果如圖所示(圖中T表示溫度,n表示H2物質的量)。
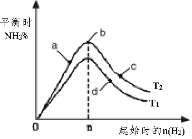
①圖象中T2和T1的關系是:T2 __________T1(填“>,<或=”,下同)
②a、b、c、d四點所處的平衡狀態中,反應物N2 的轉化率最高的是______(填字母)。
(4)恒溫下,往一個4L的密閉容器中充入5.2mol H2和2mol N2,反應過程中對NH3的濃度進行檢測,得到的數據如下表所示:
時間/min | 5 | 10 | 15 | 20 | 25 | 30 |
c(NH3)/mol·L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
①此條件下該反應的化學平衡常數K=___________。
②若維持容器體積不變,溫度不變,往原平衡體系中加入H2、N2和NH3各4mol,化學平衡將向_______反應方向移動(填“正”或“逆”)。
③N2(g)+3H2(g) ![]() 2NH3(g)△H= -92kJ/mol。在恒溫恒容的密閉容器中充入1mol N2和一定量的H2發生反應。達到平衡后,測得反應放出的熱量為18.4 kJ,混合氣體的物質的量為3.6 mol,容器內的壓強變為原來的90%,則起始時充入的H2的物質的量為______mol。
2NH3(g)△H= -92kJ/mol。在恒溫恒容的密閉容器中充入1mol N2和一定量的H2發生反應。達到平衡后,測得反應放出的熱量為18.4 kJ,混合氣體的物質的量為3.6 mol,容器內的壓強變為原來的90%,則起始時充入的H2的物質的量為______mol。
(5)已知:N2(g)+3H2(g) ![]() 2NH3(g)△H= -92kJ/mol
2NH3(g)△H= -92kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181kJ/mol
2H2(g)+O2(g)=2H2O(g) ΔH= -484kJ/mol
寫出氨氣催化氧化生成NO和水蒸氣的熱化學方程式_________。
【答案】ABCD c < c 0.1 逆 3 4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH =-906 kJ·mol-1
【解析】
(1)結合△G=△H-T△S和影響平衡的因素分析;
(2)達到平衡狀態時,正逆反應速率相等,各物質的濃度不變,以此判斷;
(3)①根據溫度升高化學平衡向著吸熱方向進行;
②根據增加氫氣的物質的量化學平衡向著正反應方向移動;
(4)①由表中數據可知,20min達平衡,平衡時NH3的濃度為0.20mol/L,利用三段式計算平衡時各組分的平衡濃度,代入平衡常數表達式k=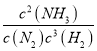 計算;
計算;
②溫度不變平衡常數不變,計算此時的濃度,進而計算濃度商Qc,比較濃度商與平衡常數的大小,判斷反應進行方向;
③恒溫恒容條件下氣體的壓強與氣體的總物質的量成正比;
(5)根據蓋斯定律來求反應的焓變。
(1)已知:N2(g) + 3H2(g) ![]() 2NH3(g) △H<0,△S <0;
2NH3(g) △H<0,△S <0;
A.當△G=△H-T△S<0時反應能自發進行,則△H<0時,△G=△H-T△S不一定小于0,即該反應不一定能自發進行,故A錯誤;
B.當△G=△H-T△S<0時反應能自發進行,則△S<0時,△G=△H-T△S不一定小于0,即該反應不一定能自發進行,故B錯誤;
C.當升高溫度時,N2(g) + 3H2(g) ![]() 2NH3(g) △H<0,平衡逆向移動,反應物的轉化率降低,升高溫度只是為了加快反應速率,故C錯誤;
2NH3(g) △H<0,平衡逆向移動,反應物的轉化率降低,升高溫度只是為了加快反應速率,故C錯誤;
D.使用催化劑能加快反應速率是因為催化劑降低了反應的活化能,但不影響反應的△H,故D錯誤;
故答案為ABCD;
(2)a.容器內N2、H2、NH3的濃度之比為1:3:2,不能說明達到判斷狀態,取決于起始配料比和轉化程度,故a錯誤;
b.當3v正(N2)=v逆(H2)時,說明達到平衡狀態,則當v正(N2)= v逆(H2) 不能說明達到平衡狀態,故b錯誤;
c.容器內壓強保持不變,說明混合氣體的總物質的量保持不變,此時反應達到平衡狀態,故c正確;
d.混合氣體的質量和體積始終保持不變,則混合氣體的密度保持不變無法說明反應達到平衡狀態,故d錯誤;
故答案為c;
(3)①反應為放熱反應,溫度升高化學平衡向著吸熱方向進行,從T1到T2反應物氮氣的量增加,故T1<T2;
②b點代表平衡狀態,溫度升高平衡逆向移動,則應選擇低溫平衡正向移動,提高反應物轉化率,另外c點又加入了氫氣,故平衡向右移動,氮氣的轉化率增大;
(4)①由表中數據可知,20min達平衡,平衡時NH3的濃度為0.20mol/L,則:
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
開始(mol/L):0.5 1.3 0
變化(mol/L):0.1 0.3 0.2
平衡(mol/L):0.4 1 0.2
故平衡常數k=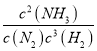 =
=![]() =0.1;
=0.1;
②反應達到平衡后,若維持容器體積不變,溫度不變,往平衡體系中加入H2、N2和NH3各4mol,則此時各物質的濃度為:H2為1mol/L+![]() =2mol/L,N2為0.4mol/L+
=2mol/L,N2為0.4mol/L+![]() =1.4mol/L,NH3為0.2mol/L+
=1.4mol/L,NH3為0.2mol/L+![]() =1.2mol/L,故濃度商Qc=
=1.2mol/L,故濃度商Qc=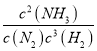 =
=![]() =0.13>0.1,故反應向逆反應移動;
=0.13>0.1,故反應向逆反應移動;
③已知N2(g)+3H2(g) ![]() 2NH3(g)△H= -92kJ/mol,在恒溫恒容的密閉容器中充入1mol N2和一定量的H2發生反應,達到平衡后,平衡時混合氣體的物質的量為3.6 mol,容器內的壓強變為原來的90%,則反應前總物質的量為3.6 mol×
2NH3(g)△H= -92kJ/mol,在恒溫恒容的密閉容器中充入1mol N2和一定量的H2發生反應,達到平衡后,平衡時混合氣體的物質的量為3.6 mol,容器內的壓強變為原來的90%,則反應前總物質的量為3.6 mol×![]() =4mol,故則起始時充入的H2的物質的量為4mol-1mol=3mol;
=4mol,故則起始時充入的H2的物質的量為4mol-1mol=3mol;
(5)已知:①N2(g)+3H2(g) ![]() 2NH3(g)△H= -92kJ/mol,②N2(g)+O2(g)=2NO(g) ΔH= +181kJ/mol,③2H2(g)+O2(g)=2H2O(g) ΔH= -484kJ/mol,由蓋斯定律②×2-①×2+③×3得:4NH3(g)+5O2(g)═4NO(g)+6H2O(g),則△H=(+181kJ/mol)×2-(-92kJ/mol)×2+(-484kJ/mol)×3=-906 kJ·mol-1,即氨氣催化氧化生成NO和水蒸氣的熱化學方程式為4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH =-906 kJ·mol-1。
2NH3(g)△H= -92kJ/mol,②N2(g)+O2(g)=2NO(g) ΔH= +181kJ/mol,③2H2(g)+O2(g)=2H2O(g) ΔH= -484kJ/mol,由蓋斯定律②×2-①×2+③×3得:4NH3(g)+5O2(g)═4NO(g)+6H2O(g),則△H=(+181kJ/mol)×2-(-92kJ/mol)×2+(-484kJ/mol)×3=-906 kJ·mol-1,即氨氣催化氧化生成NO和水蒸氣的熱化學方程式為4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH =-906 kJ·mol-1。


科目:高中化學 來源: 題型:
【題目】某課外活動小組實驗測得某硅酸鹽所含氧化物的質量分數如下表:
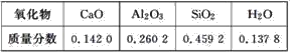
根據表中的數據請寫出
(1)該硅酸鹽的普通化學式是______________。
(2)用氧化物的形式表示該硅酸鹽的組成是____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某鋁合金中含有元素鋁、鎂、銅、硅,為了測定該合金中鋁的含量,設計了如下實驗,請回答有關問題:
(1)稱取樣品a g(精確到0.1 g),稱量時通常使用的主要儀器的名稱是_____。
(2)將樣品溶解于過量的稀鹽酸,過濾并洗滌濾渣。濾液中主要含有________,濾渣為________,溶解、過濾用到的玻璃儀器是________。
(3)向濾液中加過量的氫氧化鈉溶液,過濾并洗滌濾渣。有關的離子方程式是________________________________________________________________。
(4)向步驟(3)的濾液中通入足量的二氧化碳氣體,過濾并洗滌濾渣。有關的離子方程式是______________________________________________________________。
(5)將步驟(4)中所得的濾渣烘干并灼燒至恒重、冷卻后稱量,其質量為b g。有關反應的化學方程式是
_______________________________________________________________________,原樣品中鋁的質量分數是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有原子序數依次增大的a、b、c、d四種元素,最外層電子數分別為4、1、x、7,已知c原子的電子層數等于x,d-的電子層結構與Ar元素相同。下列說法錯誤的是( )
A.元素a與氫形成原子比為1:1的化合物有多種
B.元素b的單質能與水、無水乙醇反應
C.c的簡單離子與d-的簡單離子最外層電子數和電子層數都不相同
D.元素a與元素d可形成既含有極性共價鍵又含非極性共價鍵的化合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碘及其化合物在科研、生活等方面有廣泛用途。如圖所示為從海帶中制取碘的工藝流程。

已知:3I2+6NaOH===5NaI+NaIO3+3H2O。
請回答下列問題:
(1)分液漏斗使用前需要檢漏,檢漏方法為__________。
(2)步驟X中,萃取后分液漏斗內觀察到的現象是_____________。
(3)下列有關步驟Y的說法中正確的是_____(填字母)。
A.應控制NaOH溶液的濃度和體積
B.將碘單質轉化成碘離子進入水層
C.主要是除去海帶浸取原液中的有機雜質
D.NaOH溶液可以用乙醇代替
(4)向“上層”中加入H2SO4溶液,發生反應的化學方程式為____,操作Z的名稱為________。
(5)方案甲中采用蒸餾不合理,理由是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】奧司他韋是一種高效、高選擇性神經氨酸酶抑制劑,是目前治療流感的最常用藥物之一,是公認的抗禽流感、甲型H1N1等病毒最有效的藥物之一。其合成路線如圖所示:
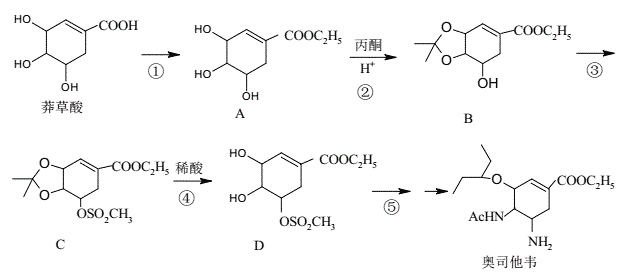
回答下列問題:
(1)莽草酸的含氧官能團名稱有__;反應③的反應類型__。
(2)反應①的反應試劑和反應條件__。
(3)1molB最多可以消耗___molNaOH溶液。
(4)請寫出反應②的化學方程式__。
(5)芳香化合物X是B的同分異構體,則符合官能團只含酚羥基的X有___種。
(6)設計由對甲基苯甲醛制備對醛基苯甲酸![]() 的合成路線__。
的合成路線__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,將![]() 和
和![]() 兩種酸溶液分別加水稀釋至體積為
兩種酸溶液分別加水稀釋至體積為![]() ,稀釋液
,稀釋液![]() 與其體積變化的關系如圖所示。下列說法正確的是 ( )
與其體積變化的關系如圖所示。下列說法正確的是 ( )

A.![]() 和
和![]() 均為一元弱酸
均為一元弱酸
B.常溫下,濃度均為![]() 的
的![]() 和
和![]() 溶液,溶液
溶液,溶液![]()
C.![]() 、
、![]() 兩點對應溶液中一定存在:
兩點對應溶液中一定存在:![]()
D.分別往![]() 、
、![]() 兩點對應溶液中滴加
兩點對應溶液中滴加![]() 溶液至恰好完全反應,消耗
溶液至恰好完全反應,消耗![]() 溶液的體積相等
溶液的體積相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在中和熱測定的實驗中,以下操作正確的是:( )
①只在大燒杯底部墊泡沫塑料,使放入的小燒杯杯口與大燒杯杯口相平,再蓋上硬紙板
②溫度計測量過鹽酸的溫度后,立即插入![]() 溶液中測量
溶液中測量![]() 溶液的溫度
溶液的溫度
③將量筒中的![]() 溶液慢慢加入到小燒杯的鹽酸中,邊加邊攪拌
溶液慢慢加入到小燒杯的鹽酸中,邊加邊攪拌
④讀取混合溶液的最高溫度和最低溫度,以其平均值記為最終溫度.
A.只有①正確B.只有②正確
C.只有①④正確D.都不正確
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸亞鐵晶體(FeSO47H2O)是醫藥上補血劑的有效成分。某課外小組測定該補血劑中鐵元素含量的流程如下(已知其它成分在測定過程中不參與反應),回答下列問題:
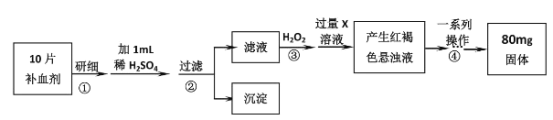
(1)步驟①研細的目的是_______。
(2)證明步驟②濾液中含有Fe2+的方法是_______。
(3)步驟③加入H2O2的目的_______,發生反應的離子方程式是_______。
(4)步驟③后過量X溶液是_______(填化學式)溶液。
(5)步驟④中一系列操作依次是_______、洗滌、灼燒、冷卻、稱量。
(6)假設實驗無損耗,正常人每天應補充16.8mg左右的鐵,如果全部通過服用上述測定的補血劑片來補充,則正常人每天需服用上述補血劑_______片。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com