
 元素周期表揭示了化學元素間的內在聯系,使其構成了一個完整的體系.
元素周期表揭示了化學元素間的內在聯系,使其構成了一個完整的體系.| m |
| ρ |
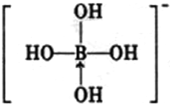 ,
, ;
;| 1 |
| 8 |
| 1 |
| 2 |
| 99g/mol |
| NA/mol |
| 99 |
| NA |
| m |
| ρ |
| ||
| ag/cm3 |
| 99 |
| NA |
| 99 |
| NA |


 學練快車道口算心算速算天天練系列答案
學練快車道口算心算速算天天練系列答案科目:高中化學 來源: 題型:
| ||
| ||
| ||
| ||
| A、①② | B、②③ | C、③④ | D、①④ |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
 科學研究表明,月球上可能存在少量水:月巖中含有鈦鐵礦,其主要成分的晶胞如圖所示.
科學研究表明,月球上可能存在少量水:月巖中含有鈦鐵礦,其主要成分的晶胞如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
| 3 |
| 4 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
 有人設想以N2和H2為反應物,以溶有A的稀鹽酸為電解質溶液,可制造出既能提供電能,又能固氮的新型燃料電池,裝置如圖所示.電池正極的電極反應式是
有人設想以N2和H2為反應物,以溶有A的稀鹽酸為電解質溶液,可制造出既能提供電能,又能固氮的新型燃料電池,裝置如圖所示.電池正極的電極反應式是查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com