
| A. | 23gNO2和N2O4的混合氣體中含原子總數為1.5NA | |
| B. | 31g白磷P4(如圖)中所含的P-P鍵的個數為0.25NA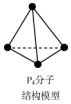 | |
| C. | 足量的Cu與100mL18.4mol/L的濃硫酸反應,失去3.68NA個電子 | |
| D. | 濃度均為2.0mol/L的鹽酸和醋酸溶液各100mL,其含氫離子均為0.2NA |
分析 A.NO2和N2O4的最簡式為NO2,根據最簡式計算混合物中含有原子總數;
B. 分子中含有6個P-P鍵,根據n=$\frac{m}{M}$計算出P4的物質的量,然后計算出含有P-P鍵數目;
分子中含有6個P-P鍵,根據n=$\frac{m}{M}$計算出P4的物質的量,然后計算出含有P-P鍵數目;
C.銅足量,稀硫酸不與銅反應,則轉移電子的數目減少;
D.醋酸為弱酸,在溶液中部分電離.
解答 解:A.23gNO2和N2O4的混合氣體中含23g最簡式為NO2,含有最簡式NO2的物質的量為:$\frac{23g}{46g/mol}$=0.5mol,含有原子的物質的量為:0.5mol×3=1.5mol,則該混合物中含有原子總數為1.5NA,故A正確;
B.根據 可知,1mol白磷中有6molP-P,31g白磷中P4物質的量為:$\frac{31g}{31g/mol×4}$=0.25mol,含有P-P的物質的量為:0.25mol×6=1.5mol,所含的P-P鍵的個數為1.5NA;故B錯誤;
可知,1mol白磷中有6molP-P,31g白磷中P4物質的量為:$\frac{31g}{31g/mol×4}$=0.25mol,含有P-P的物質的量為:0.25mol×6=1.5mol,所含的P-P鍵的個數為1.5NA;故B錯誤;
C.足量的Cu與100mL18.4mol/L的濃硫酸反應,濃硫酸變成稀硫酸后反應停止,則反應失去電子的數目小于3.68NA,故C錯誤;
D.100mL 2.0mol/L的鹽酸中含有HCl的物質的量為0.2mol,HCl為強電解質,完全電離,則鹽酸中氫離子的物質的量為0.2mol,而醋酸為弱酸,只能部分電離,則醋酸中氫離子的物質的量小于0.2mol,故D錯誤;
故選A.
點評 本題考查阿伏加德羅常數的應用,題目難度中等,注意掌握好以物質的量為中心的各化學量與阿伏加德羅常數的關系,試題有利于培養學生的邏輯推理能力,提高學生靈活運用基礎知識解決實際問題的能力.


科目:高中化學 來源: 題型:選擇題
| A. | NH3$→_{催化劑△}^{O_{2}}$NO2$\stackrel{H_{2}O_{2}(aq)}{→}$HNO3 | |
| B. | 含2molHCl的濃鹽酸$→_{△}^{總量MnO_{2}}$0.5molCl2$\stackrel{石灰石}{→}$0.25molCa(ClO)2 | |
| C. | 飽和NaCl溶液$\stackrel{NH_{3}.CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| D. | 海水$\stackrel{熟石灰}{→}$Mg(OH)2$\stackrel{稀鹽酸}{→}$MgCl2(aq)$\stackrel{通電}{→}$Mg |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 電燈通電發出光 | B. | 水力發電產生電能 | ||
| C. | 液化石油氣燃燒放出熱量 | D. | 電熨斗通電發出熱量 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溶液pH先變大后變小 | B. | 溶液導電能力逐漸增強 | ||
| C. | 氫硫酸完全反應生成1.6g硫 | D. | 這個反應可以證明還原性Cl->S2- |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 ,水溶液是弱(填“強、弱”)酸,寫出氫硫酸的電離方程式H2S?HS-+H+.其水溶液在空氣中放置一段時間后會出現淡黃色的S沉淀現象,該反應的化學方程式是2H2S+O2=2S+2H2O,所以硫化氫水溶液不能長期放置.盛放硫化氫水溶液的試劑瓶壁上常有一些固體,可用CS2(填化學式)洗滌除去.
,水溶液是弱(填“強、弱”)酸,寫出氫硫酸的電離方程式H2S?HS-+H+.其水溶液在空氣中放置一段時間后會出現淡黃色的S沉淀現象,該反應的化學方程式是2H2S+O2=2S+2H2O,所以硫化氫水溶液不能長期放置.盛放硫化氫水溶液的試劑瓶壁上常有一些固體,可用CS2(填化學式)洗滌除去.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | $\frac{(a+c)}{(a+b)}$ | B. | $\frac{(a+2c)}{(a+b+c)}$ | C. | $\frac{2(a+c)}{(a+2b+c)}$ | D. | $\frac{(a+2c)}{(a+2b)}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 質子數為24 | B. | 氣態氫化物為H2Se | ||
| C. | 非金屬性比溴弱 | D. | 最高價含氧酸為H2SeO4 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com