
【題目】以NA表示阿伏加德羅常數,下列說法正確的是( )
A. 12g石墨中含有C-C鍵的個數為3NA
B. 7.8gNa2O2晶體中含有陰陽離子總數為0.4NA
C. 1molSiO2晶體中含有4NA個Si-O鍵
D. 78g苯中含![]() 鍵的數目為3NA
鍵的數目為3NA
科目:高中化學 來源: 題型:
【題目】(1)鉛蓄電池的正極的反應式_________。
(2)由 Mg、Al和氫氧化鈉溶液組成的原電池中,負極的反應式 ________。當在電極上產生氣體3.36L(標準狀況)時,導線中通過的電子電子數目為_____個(用 NA表示阿伏加德羅常數的值)。
(3)日本茨城大學研制了一種新型的質子交換膜二甲醚燃料電池(DDFC),該電池有較高的安全性。電池總反應為:CH3OCH3+3O2=2CO2+3H2O,電池結構如下圖所示,據此回答下列問題:
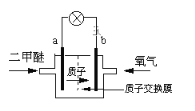
a極為電池的____極,b電極上的電極反應式為____。電池工作時電流的方向是由_______(填“a”或“b”, 下同)經導向______。電池工作時,若有0.1mol二甲醚被氧化時,有_______mol電子發生轉移。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碘化鈉用作甲狀腺腫瘤防治劑、祛痰劑和利尿劑等. 實驗室用NaOH、單質碘和水合肼(N2H4·H2O)為原料可制備碘化鈉。資料顯示:水合肼有還原性,能消除水中溶解的氧氣;NaIO3是一種氧化劑.
回答下列問題:
(1)水合肼的制備有關反應原理為: NaClO+2NH3 = N2H4·H2O+NaCl
①用下圖裝置制取水合肼,其連接順序為_________________(按氣流方向,用小寫字母表示).
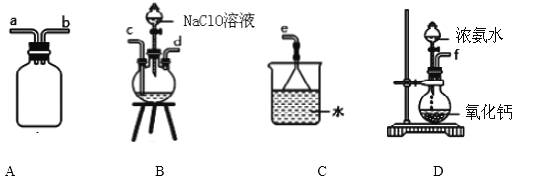
②開始實驗時,先向氧化鈣中滴加濃氨水,一段時間后再向B的三口燒瓶中滴加 NaClO溶
液.滴加 NaClO溶液時不能過快的理由_________________________________________。
(2)碘化鈉的制備
i.向三口燒瓶中加入8.4gNaOH及30mL水,攪拌、冷卻,加入25.4g碘單質,開動磁力攪拌器,保持60~70℃至反應充分;
ii.繼續加入稍過量的N2H4·H2O(水合肼),還原NaIO和NaIO3,得NaI溶液粗品,同時釋放一種空氣中的氣體;
iii.向上述反應液中加入1.0g活性炭,煮沸半小時,然后將溶液與活性炭分離;
iv.將步驟iii分離出的溶液蒸發濃縮、冷卻結晶、過濾、洗滌、干燥,得產品24.0g.
③步驟i反應完全的現象是______________________。
④步驟ii中IO3-參與反應的離子方程式為________________________________________。
⑤步驟iii “將溶液與活性炭分離”的方法是______________________。
⑥本次實驗產率為_________,實驗發現,水合肼實際用量比理論值偏高,可能的原因是_____________。
⑦某同學檢驗產品NaI中是否混有NaIO3雜質. 取少量固體樣品于試管中,加水溶解,滴加少量淀粉液后再滴加適量稀硫酸,片刻后溶液變藍. 得出NaI中含有NaIO3雜質. 請評價該實驗結論的合理性:_________(填寫“合理”或“不合理”),_________(若認為合理寫出離子方程式,若認為不合理說明理由).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知4NH3(g)+5O2(g)═4NO(g)+6H2O(g),若反應速率分別用v(NH3)、v(O2)、v(NO)、v(H2O)表示,則正確的關系式為
A. 4v(NH3)=5v(O2) B. 5v(O2)=6v(H2O)
C. 2v(NH3)=3v(H2O) D. 4v(O2)=5v(NO)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某充電寶鋰離子電池的總反應為:xLi+Li1-xMn2O4 ![]() LiMn2O4,某手機鎳氫電池總反應為:NiOOH+MH
LiMn2O4,某手機鎳氫電池總反應為:NiOOH+MH ![]() M+Ni(OH)2(M為儲氫金屬或合金),有關上述兩種電池的說法不正確的是( )
M+Ni(OH)2(M為儲氫金屬或合金),有關上述兩種電池的說法不正確的是( )
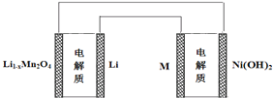
A. 鋰離子電池放電時Li+向正極遷移
B. 鎳氫電池放電時,正極的電極反應式:NiOOH+H2O+e-=Ni(OH)2+OH-
C. 下圖表示用鋰離子電池給鎳氫電池充電
D. 鋰離子電池放電時,負極的電極反應式:Li1-xMn2O4+xLi+-xe-=LiMn2O4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應N2(g)+3H2(g)![]() 2NH3(g) △H<0,若在恒壓絕熱的容器中發生,下列選項表明一定已達平衡狀態的是
2NH3(g) △H<0,若在恒壓絕熱的容器中發生,下列選項表明一定已達平衡狀態的是
A. 容器內的溫度不再變化
B. 容器內的壓強不再變化
C. 相同時間內,斷開H-H鍵的數目和生成N-H鍵的數目相等
D. 容器內氣體的濃度c(N2):c(H2):c(NH3)=1:3:2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】能證明硅酸的酸性弱于碳酸的實驗事實是
A. CO2溶于水形成碳酸,SiO2難溶于水
B. CO2通入可溶性硅酸鹽溶液中析出硅酸沉淀
C. 高溫下SiO2與碳酸鹽反應生成CO2
D. 氯化氫通入可溶性碳酸鹽溶液中放出氣體,通入可溶性硅酸鹽溶液中生成沉淀
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com