
(1)若固體恰好全部溶解,消耗硫酸的體積為V,則V的取值范圍為_________。
(2)若硫酸溶液過量,反應后溶液的體積為1 L,測得溶液中Fe2+濃度為0.1 mol·L-1,則原始混合物中含銅的質量為_________。
(1)0.3 L≤V<0.42 L (2)14.4 g或3.2 g
解析:固體全部溶解,涉及的反應有:
①Fe2O3+3H2SO4![]() Fe2(SO4)3+3H2O
Fe2(SO4)3+3H2O
②Fe2(SO4)3+Cu![]() 2FeSO4+CuSO4
2FeSO4+CuSO4
假設固體只有Fe2O3,反應僅按①進行,顯然恰好反應時,應滿足:1 mol·L-1×V=3×22.4 g/160 g·mol-1,解得V=0.42 L。
假設固體是Cu和Fe2O3的混合物,反應按①②兩式進行,若要固體恰好溶解,物質的量應滿足:n(Cu)=n〔Fe2(SO4)3〕=n(Fe2O3)=x mol,依題意:64x+160x=22.4,解得x=0.1
由反應①得關系式1 mol·L-1×V=3×0.1 mol,V=0.3 L。
所以V的取值范圍是:0.3 L≤V<0.42 L
(2)溶液中,n(Fe2+)=0.1 mol,它是由反應式②生成的,因為Fe2(SO4)3和Cu誰過量,題目中不明確,故需要加以討論。
若Cu過量,是n(Fe2O3)=n〔Fe2(SO4)3〕=1/2n(Fe2SO4)=0.05 mol,Cu的質量為:22.4 g-m(Fe2O3)=22.4 g-0.05 mol×160 g·mol-1=14.4 g
若Fe2(SO4)3過量,則n(Cu)=1/2n(FeSO4)=0.05 mol,Cu的質量為0.05 mol×64 g·mol-1=3.2 g
綜上討論,原混合物中銅的質量為14.4 g或3.2 g。


科目:高中化學 來源: 題型:


| ||
| ||
| 168Q |
| m |
| 168Q |
| m |
查看答案和解析>>
科目:高中化學 來源: 題型:

| ||
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
(1)若固體恰好全部溶解,消耗硫酸的體積為V,則V的取值范圍為_________________。
(2)若硫酸溶液過量,反應后溶液的體積為1 L,測得溶液中Fe 2+濃度為0.1 mol·L -1,則原始混合物中含銅的質量為__________________________。
查看答案和解析>>
科目:高中化學 來源:2011屆福建省寧德市高三普通高中畢業班質量檢查(理綜)化學部分 題型:填空題
硫鐵礦燒渣是硫鐵礦生產硫酸過程中產生的工業廢渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等雜質)。用該燒渣制取藥用輔料——紅氧化鐵的工藝流程如下: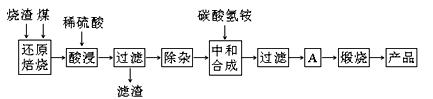
(1)在“還原焙燒”中產生的有毒氣體可能有 。
(2)“酸浸”時間一般不超過20 min,若在空氣中酸浸時間過長,溶液中Fe2+含量將下降,其原因用離子方程式表示: 。
(3)根據下表數據:
| 氫氧化物 | Al(OH)3 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 開始沉淀的pH | 3.10 | 8.54 | 2.01 | 7.11 |
| 完全沉淀的pH | 4.77 | 11.04 | 3.68 | 9.61 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com