
【題目】現有以下物質:①CCl4 ②Ag ③氨水 ④SO2 ⑤小蘇打固體 ⑥Fe(OH)3膠體 ⑦FeCl3溶液
(1)以上物質屬于電解質的是_____,屬于非電解質的是_____;(填序號)
(2)請寫出將少量SO2通入小蘇打溶液中反應的離子方程式:_____;
(3)鑒別膠體和溶液最簡單有效的物理方法是_____;分離膠體和溶液常用的物理方法是_____;
(4)寫出實驗室制備NH3的化學方程式_____;為了收集干燥的NH3,下面可選用_____作干燥劑。(填字母序號)
A.濃硫酸 B.堿石灰 C.無水硫酸銅
【答案】⑤ ①④ 2HCO3﹣+SO2=2CO2+SO32﹣+H2O 丁達爾效應 滲析 2NH4C1+Ca(OH)2![]() 2NH3↑+CaC12+2H2O B
2NH3↑+CaC12+2H2O B
【解析】
(1)在水溶液或熔融狀態下能導電的化合物為電解質,在水溶液和熔融狀態下不導電的化合物為非電解質;
(2)SO2與碳酸氫鈉反應生成亞硫酸鈉和二氧化碳;
(3)鑒別膠體和溶液最簡單有效的物理方法是丁達爾效應;分離膠體和溶液常用的物理方法是滲析;
(4)實驗室用氯化銨晶體和氫氧化鈣晶體混合來制備氨氣;氨氣是堿性氣體,選擇堿性干燥劑干燥。
(1)①CCl4在熔融狀態和水溶液中都不能導電,是非電解質;
②Ag為金屬單質,既不是電解質也不是非電解質;
③氨水能夠導電,但是混合物,既不是電解質也不是非電解質;
④液態SO3在水溶液中能夠導電,但自身不能電離,是非電解質;
⑤小蘇打固體在水溶液中能夠導電,是電解質;
⑥Fe(OH)3膠體是混合物,既不是電解質也不是非電解質;
⑦FeCl3溶液,能夠導電,但是混合物,既不是電解質也不是非電解質;
故屬于電解質的是:⑤,屬于非電解質的是:①④;
(2)將少量SO2通入小蘇打溶液中發生反應生成亞硫酸鈉和二氧化碳,離子方程式為:2HCO3﹣+SO2=2CO2+SO32﹣+H2O;
(3)溶液中通過一束光線沒有特殊現象,膠體中通過一束光線出現光亮光路,為丁達爾現象,可以區別溶液和膠體;膠體不能透過半透膜,溶液可以透過半透膜,利用半透膜可以分離膠體與溶液,操作為滲析;
(4)實驗室用氯化銨晶體和氫氧化鈣晶體混合來制備氨氣,反應方程式:2NH4C1+Ca(OH)2![]() 2NH3↑+CaC12+2H2O;氨氣是堿性氣體,選擇堿性干燥劑干燥,因此選擇堿石灰作干燥劑。
2NH3↑+CaC12+2H2O;氨氣是堿性氣體,選擇堿性干燥劑干燥,因此選擇堿石灰作干燥劑。


科目:高中化學 來源: 題型:
【題目】下列說法或表示方法正確的是
A. 由C(石墨,s)=C(金剛石,s)ΔH = +1.9 kJ·mol-1可知,金剛石比石墨穩定
B. 已知S(g)+O2(g)═SO2(g) ΔΗ1 ;S(s)+O2(g)═SO2(g) ΔΗ2 ,則ΔΗ1<ΔΗ2
C. 在101kPa時,2g H2完全燃燒生成液態水,放出285.8kJ熱量,氫氣燃燒的熱化學方程式表示為2H2(g)+O2(g)![]() 2H2O(l) ΔH = +285.8 kJ·mol-1
2H2O(l) ΔH = +285.8 kJ·mol-1
D. 在稀溶液中:H +(aq)+OH -(aq)= H2O(l)ΔH =-57.3 kJ·mol-1,若將含1mol CH3COOH與含1mol NaOH的溶液混合,放出的熱量等于57.3 kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室可用下圖裝置探究石蠟油分解產物的性質,下列說法錯誤的是
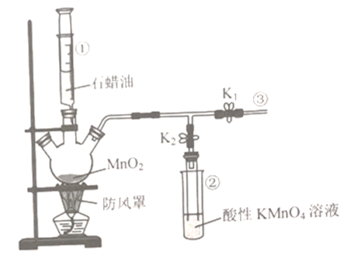
A.儀器①可控制石蠟油滴加的速率
B.裝置②起到防倒吸的作用
C.實驗過程中,關閉K1,打開K2,裝置②中溶液顏色逐漸褪去
D.加熱一段時間后,關閉K2,打開K1,在③處點燃氣體可看到淡藍色火焰
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2019年諾貝爾化學獎頒發給三位開發鋰離子電池的科學家。鋰離子電池正極材料是決定其性能的關鍵.
(1)錳酸鋰(LiMn2O4)電池具有原料成本低、合成工藝簡單等優點。Li+能量最低的激發態離子的電子排布圖為________,該晶體結構中含有Mn4+,基態Mn4+核外價層電子占據的軌道數為__________________個。
(2)磷酸鐵鋰(LiFePO4)電池安全、充電快、使用壽命長,其中P原子的雜化方式為__________________,陰離子的空間結構為__________________。
(3)三元正極材料![]() 摻雜Al3+可使其性能更優,第四電離能:Mn__________________Al(填“大于”“小于”),原因是__________________。
摻雜Al3+可使其性能更優,第四電離能:Mn__________________Al(填“大于”“小于”),原因是__________________。
(4)鉍化鋰被認為是很有潛力的正極材料,晶胞結構如圖所示。

①晶胞可以看作是由鉍原子構成的面心立方晶格,鋰原子填充在其中的四面體和八面體空隙處。晶體的化學式為__________________,圖中鉍原子坐標參數:A為(0,0,0), B為(0,1,1),C為__________________。
②若晶胞參數為anm,則鉍原子的半徑為__________________nm,八面體間隙中的鋰原子與四面體間隙中的鋰原子之間的最短距離為__________________nm。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有Fe2O3 、CuO的混合物,在足量H2氣流中,加熱充分反應,冷卻后稱得剩余固體比原混合物減輕1.6 g;若將等質量的原混合物與鹽酸反應,欲使之完全溶解,需1 mol/L的鹽酸的體積至少為( )
A.0.05 LB.0.1 LC.0.2 LD.0.4 L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組中的兩種物質作用時,反應條件(溫度或反應物用量改變),不會引起產物種類改變的是![]()
![]()
A.Na2O2和CO2B.Na2CO3和HCl
C.Na和O2D.NaHSO4和Ba(OH)2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖為不同化學元素組成的化合物示意圖,以下說法不正確的是 ( )
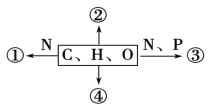
A. 若①為某種具有催化作用的化合物,則①的初步水解產物為多肽,徹底水解產物為氨基酸
B. 若②大量積累于皮下和內臟器官周圍,則②為脂肪
C. 若③為構成細胞膜基本骨架的分子,則③為磷脂
D. 若④在低血糖時分解以補充血糖,則④可能是肌糖原和肝糖原
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向絕熱恒容密閉容器中通入CO和H2O(g),在一定條件下使反應CO(g)+H2O(g)![]() CO2(g)+H2(g)達到平衡,正反應速率隨時間變化的示意圖如圖所示。由圖可得出的正確結論是( )
CO2(g)+H2(g)達到平衡,正反應速率隨時間變化的示意圖如圖所示。由圖可得出的正確結論是( )
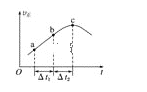
A. 反應物的總能量低于生成物的總能量
B. Δt1=Δt2時,CO的轉化率:a~b段小于bc段
C. 反應在c點達到平衡狀態
D. 反應物濃度:a點小于b點
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室常用堿性溶液吸收多余的氯氣,防止污染環境。若某一次興趣小組實驗中將多余的氯氣用100 mL 2.00 mol·L-1的NaOH溶液恰好完全吸收。分析吸收液測得ClO-和![]() 的物質的量濃度之比為5∶1。請回答:
的物質的量濃度之比為5∶1。請回答:
(1)吸收的氯氣的物質的量為____mol。
(2)若不考慮吸收前后溶液體積變化,則吸收液中Cl-的物質的量濃度為________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com