
| A. | 容器中含D物質的量至少為0.45 mol | |
| B. | A的平均反應速率是0.010 mol•L-1•s-1 | |
| C. | 容器中A、B、C、D的物質的量之比一定是4:5:4:6 | |
| D. | 容器中A的物質的量一定增加了0.30 mol |
分析 A.半分鐘后,C的物質的量增加了0.30mol,由方程式可知生成的D為0.45mol,D的起始量不一定為0;
B.根據v=$\frac{△c}{△t}$計算v(C),再根據速率之比等于化學計量數之比計算v(A);
C.平衡時各組分的物質的量之比與物質的起始投入的量及轉化率有關;
D.A為反應物,C為生成物,C的物質的量增大,則A的一定減小.
解答 解:A.C的物質的量增加了0.30mol,根據方程式4A(g)+5B(g)=4C(g)+6D(g)可知,生成D的物質的量為0.45mol,D的起始量不一定為0,故容器中含D物質的量至少為0.45 mol,故A正確;
B.v(C)=$\frac{\frac{0.3mol}{5L}}{30s}$=0.002mol•L-1•s-1,速率之比等于化學計量數之比,所以v(A)=v(C)=0.002mol•L-1•s-1,故B錯誤;
C.半分鐘后,容器中A、B、C、D的物質的量的比與物質的起始投入的量及轉化率有關,可能為4:5:4:6,可能不是,故C錯誤;
D.C的物質的量增加了0.30mol,根據方程式4A(g)+5B(g)=4C(g)+6D(g)可知,參加反應的A的物質的量為0.3mol,A減小0.3mol,故D錯誤,
故選:A.
點評 本題考查化學平衡計算、反應速率計算,難度不大,注意物質的起始量不確定,加強基礎知識的學習掌握.


 優加精卷系列答案
優加精卷系列答案科目:高中化學 來源: 題型:填空題
 如圖所示,在燒瓶中盛飽和氯水,并滴有酚酞溶液,試填寫以下空白:
如圖所示,在燒瓶中盛飽和氯水,并滴有酚酞溶液,試填寫以下空白:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 正丁醛是一種重要的化工原料.肥西中學高二某化學興趣小組在老師的指導下利用如圖裝置合成正丁醛.發生的反應如下:
正丁醛是一種重要的化工原料.肥西中學高二某化學興趣小組在老師的指導下利用如圖裝置合成正丁醛.發生的反應如下:| 沸點/.c | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
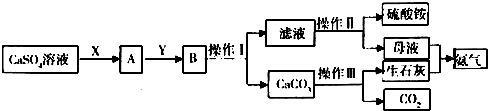

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 實驗室制備1,2-二溴乙烷的反應原理如下:
實驗室制備1,2-二溴乙烷的反應原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 狀態 | 無色液體 | 無色液體 | 無色液體 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸點/℃ | 78.5 | 132 | 34.6 |
| 熔點/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
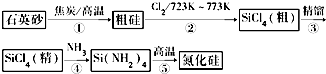
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| t/min | 2 | 4 | 7 | 9 |
| n(I2)/mol | 0.012 | 0.011 | 0.010 | 0.010 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | K+、MnO4-、Na+、Cl- | B. | Na+、Cl-、NO3-、SO42- | ||
| C. | K+、Na+、NO3-、HCO3- | D. | Fe3+、Na+、CO32-、SO42- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com