
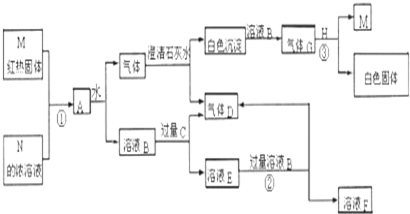
分析 根據題中各物質轉化關系,紅熱的M與N的濃溶液反應生成混合氣體,應為碳與濃硝酸或濃硫酸的反應,A與水生成氣體和溶液B,氣體與石灰水生成氣體D,溶液B與過量C也生成氣體D,C為常見金屬,則M為碳,N為濃硝酸,A為CO2和NO2的混合氣體,溶液B為硝酸,A與水反應得到的氣體為NO和CO2的混合氣體,通過石灰水后得氣體D為NO,溶液B與過量C得E,E與過量B反應得F,則金屬C有可變化合價,所以C為鐵,E為硝酸亞鐵,白色沉淀與硝酸反應得氣體G為CO2,H為常見金屬,CO2與H反應得M,則H為Mg,白色固體為MgO,據此答題.
解答 解:根據題中各物質轉化關系,紅熱的M與N的濃溶液反應生成混合氣體,應為碳與濃硝酸或濃硫酸的反應,A與水生成氣體和溶液B,氣體與石灰水生成氣體D,溶液B與過量C也生成氣體D,C為常見金屬,則M為碳,N為濃硝酸,A為CO2和NO2的混合氣體,溶液B為硝酸,A與水反應得到的氣體為NO和CO2的混合氣體,通過石灰水后得氣體D為NO,溶液B與過量C得E,E與過量B反應得F,則金屬C有可變化合價,所以C為鐵,E為硝酸亞鐵,白色沉淀與硝酸反應得氣體G為CO2,H為常見金屬,CO2與H反應得M,則H為Mg,白色固體為MgO,
(1)根據上面的分析可知,C為Fe,D為NO,H為Mg,
故答案為:Fe;NO;Mg;
(2)反應①的化學方程式為C+4HNO3(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,反應②的化學方程式為3Fe(NO3)2+4HNO3=3Fe(NO3)3+NO↑+2H2O,反應③的化學方程式為2Mg+CO2$\frac{\underline{\;點燃\;}}{\;}$2MgO+C,
故答案為:C+4HNO3(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;3Fe(NO3)2+4HNO3=3Fe(NO3)3+NO↑+2H2O;2Mg+CO2$\frac{\underline{\;點燃\;}}{\;}$2MgO+C.
點評 本題考查無機物推斷,涉及Fe、N元素化合物的性質與轉化,物質間的反應特征是推斷突破口,需要熟練掌握元素化合物知識,題目難度較大.


科目:高中化學 來源: 題型:選擇題
| A. | 元素Y、Z、W形成的離子具有相同電子層結構,其離子半徑依次增大 | |
| B. | 39g Z2Y2中含有的離子數約為1.204×1024 | |
| C. | 元素Z、R的氧化物的水化物之間相互反應生成的鹽溶液一定呈中性 | |
| D. | 元素Y、R分別與元素X形成的化合物的熱穩定性:XmY>XmR |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
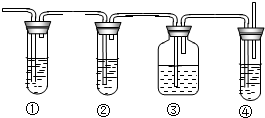 實驗室里用乙醇和濃硫酸來制取乙烯:
實驗室里用乙醇和濃硫酸來制取乙烯:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
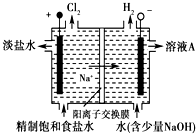 氯堿工業中電解飽和食鹽水的原理示意圖如圖所示
氯堿工業中電解飽和食鹽水的原理示意圖如圖所示查看答案和解析>>
科目:高中化學 來源: 題型:解答題
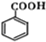 .
.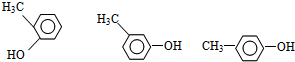 (任選一種).
(任選一種).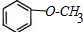 .
.查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 稱量時,將固體NaOH放在小燒杯中,再放在天平左盤上 | |
| B. | 將稱量好的固體NaOH放入容量瓶中,加蒸餾水溶解 | |
| C. | 定容時如果加水超過了刻度線,用膠頭滴管直接吸出多余部分 | |
| D. | 將燒杯中溶解固體NaOH所得溶液,冷卻到室溫后轉移至容量瓶中 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 濃度、溫度、壓強、催化劑既是影響反應速率的因素又是影響反應限度的因素 | |
| B. | 合成氨反應在一定條件下達到平衡后,N2、H2、NH3物質的量之比保持恒定 | |
| C. | 化學反應的限度決定于反應物的性質,與外界條件無關 | |
| D. | 增大反應物的用量一定會加快反應速率 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③④ | B. | ③①②④ | C. | ④②①③ | D. | ③②①④ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com