
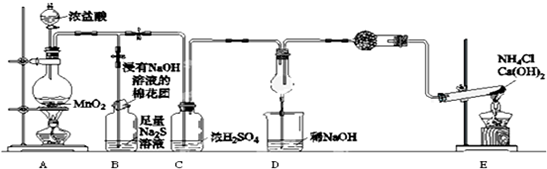
分析 非金屬性強弱比較的一般規律是:①根據氧化還原反應判斷:同一化學反應,氧化劑的氧化性強于氧化產物的氧化性;②由對應氫化物的穩定性判斷:氫化物越穩定,非金屬性越強.③由最高價氧化物對應水化物的酸性來判斷:酸性越強,非金屬越強.(除氟元素之外).④非金屬單質與具有可變價金屬的反應.能生成高價金屬化合物的,其非金屬性強,據此可以驗證.
為驗證非金屬元素氯的氧化性強于硫,該實驗通過氯氣把硫化鈉溶液中的硫離子氧化為S單質說明,為驗證非金屬元素氯的氧化性強于氮,通過氯氣能把氨氣氧化生成氮氣和氯化氫說明,實驗裝置中,A制取氯氣:MnO2+4HCl(濃)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,濃鹽酸易揮發,經過濃硫酸干燥的氯氣中扔混有少量氯化氫氣體,因此需要在C加一吸收裝置除掉氯化氫,需要在C之前加裝洗氣裝置,為該實驗裝置設計缺陷,B裝置為為驗證非金屬元素氯的氧化性強于硫,B中出現黃色渾濁現象,說明有S沉淀生成,氯氣的氧化性大于S的氧化性,反應為:Cl2+S2-=S↓+2Cl-,裝置C進行干燥氯氣,盛放氫氧化鈉的燒杯吸收尾氣,裝置E為:氯化銨和氫氧化鈣固體加熱反應生成氨氣,反應的化學方程式為2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+CaCl2;裝置D氯氣能把氨氣氧化生成氮氣和氯化氫,生成的氯化氫和氨氣結合生成氯化銨,從而冒白煙,驗證非金屬元素氯的氧化性強于氮.
(1)此反應裝置為濃鹽酸和二氧化錳共熱制備氯氣,以此寫出化學方程式;
(2)B中出現黃色渾濁現象,說明有S沉淀生成,氯氣的氧化性大于S的氧化性;
(3)氯氣污染環境,浸有NaOH溶液的棉花團可以吸收多余的氯氣;
(4)裝置E為實驗室制取氨氣的裝置,氯氣能把氨氣氧化生成氮氣和氯化氫,氯化氫與氨氣反應生成氯化銨,故現象為冒白煙;
(5)濃鹽酸易揮發,經過濃硫酸干燥的氯氣中仍混有少量氯化氫氣體,因此需要在C加一吸收裝置除掉氯化氫;
(6)依據非金屬性強弱比較的一般規律進行驗證.
解答 解:(1)反應裝置A為濃鹽酸和二氧化錳共熱制備氯氣的裝置,其離子方程式為:MnO2+4H++2Cl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案為:MnO2+4H++2Cl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)反應制備的氯氣通入B之后,B中出現黃色渾濁現象,說明氯氣把硫化鈉溶液中的硫離子氧化為S單質,離子方程式為Cl2+S2-=S↓+2Cl-,
故答案為:Cl2+S2-=S↓+2Cl-;
(3)氯氣污染環境,浸有NaOH溶液的棉花團可以吸收多余的氯氣,反應為:Cl2+2NaOH═NaCl+NaClO+H2O,
故答案為:吸收多余的氯氣;
(4)通E裝置是制備氨氣,氯氣能把氨氣氧化生成氮氣和氯化氫,生成的氯化氫和氨氣結合生成氯化銨,從而冒白煙,因此實驗的現象是產生大量白煙,反應的方程式是8NH3+3Cl2=6NH4Cl+N2,
故答案為:產生大量白煙;8NH3+3Cl2=6NH4Cl+N2;
(5)鹽酸易揮發,所以生成氯氣中含有氯化氫氣體,氯化氫也能直接和氨氣結合冒白煙,所以需要在C之前連接一盛有飽和食鹽水的裝置以除去氯化氫氣體,裝置圖為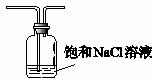 ,
,
故答案為:氯化鈉;
(6)非金屬性強弱比較的一般規律是:①由對應氫化物的穩定性判斷:氫化物越穩定,非金屬性越強.②由最高價氧化物對應水化物的酸性來判斷:酸性越強,非金屬越強.(除氟元素之外).③非金屬單質與具有可變價金屬的反應.能生成高價金屬化合物的,其非金屬性強,據此可以驗證,所以還可用以下方法能證明氧化性Cl2>S,方法一:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3、Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS;方法二:相同溫度下相同狀態的HCl的穩定性大于H2S;方法三:最高價氧化物對應的水化物的酸性HClO4 大于H2SO4.用化學方程式表示選擇方法一,
故答案為:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3、Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS.
點評 本題考查實驗方案的設計與評價,考查了氯氣、氨氣的實驗室制法及性質的檢驗,明確制備原理及物質的性質是解題關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| 實驗目的 | 實驗方案 | |
| A | 檢驗碳與濃硫酸反應后的氣體產物 | 將產生的氣體依次通過無水CuSO4、澄清石灰水和品紅溶液 |
| B | 證明蛋白質在某些無機鹽溶液作用下發生變性 | 向雞蛋清溶液中加入飽和硫酸鈉溶液,有沉淀析出;再把沉淀加入蒸餾水中 |
| C | 檢驗蔗糖水解產物具有還原性 | 向蔗糖溶液中加入幾滴稀硫酸,水浴加熱幾分鐘,然后加入適量稀NaOH溶液,再向其中加入新制的銀氨溶液,并水浴加熱 |
| D | 證明非金屬性S>C | 測定等物質的量濃度的Na2SO3與Na2CO3溶液的pH,后者較大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1mol Na參加氧化還原反應時電子轉移NA | |
| B. | 3.2g SO2與2.3g NO2所含有的氧原子數相等 | |
| C. | 標準狀況下,2.24L H2O含有的O原子數為0.1NA | |
| D. | 1L 0.1mol/LMgCl2溶液中Cl-離子數為0.2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | As的最高正價為+3價 | B. | AsH3的穩定性比PH3強 | ||
| C. | 氧化物的水化物酸性:As<N | D. | As是第4周期第VA族元素 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應(1)中SO2氧化性比HI強 | |
| B. | 循環過程中不需要補充H2O | |
| C. | 循環過程H2O作催化劑 | |
| D. | 循環過程中產生1mol H2的同時產生0.5mol O2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 在一定條件下能與溴發生取代反應 | |
| B. | 能被高錳酸鉀酸性溶液氧化 | |
| C. | 在加熱和催化劑作用下,能與氫氣反應 | |
| D. | 所有碳原子不可能共面且不能與氫溴酸發生加成反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 乙酸正丁酯是一種重要化工原料,某實驗小組利用圖1、圖2裝置合成乙酸正丁酯(夾持裝置已略去),發生的化學反應為:
乙酸正丁酯是一種重要化工原料,某實驗小組利用圖1、圖2裝置合成乙酸正丁酯(夾持裝置已略去),發生的化學反應為:| 相對分子質量 | 沸點/℃ | 密度(g/cm3) | 水中溶解度 | |
| 正丁醇 | 74 | 117.2 | 0.80 | 微溶 |
| 乙酸 | 60 | 118.1 | 1.05 | 易溶 |
| 乙酸正丁酯 | 116 | 126.5 | 0.90 | 微溶 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③中的氧化產物分別是I2、Fe3+、CoCl2 | |
| B. | 根據以上方程式可以得到氧化性Cl2>Fe3+>Co2O3 | |
| C. | 在③反應中當1molCo2O3參加反應時,2molHCl被氧化 | |
| D. | 可以推理得到Cl2+FeBr2═FeCl2+Br2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com