
【題目】下列有關如圖有機物說法正確的是
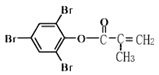
A.有機物中所有原子均在同一平面內
B.可發生的反應類型有取代、加成、還原、水解、氧化
C.1 mol 該化合物最多能與含5 mol NaOH的溶液反應
D.既能使酸性KMnO4 溶液褪色,又能與FeCl3溶液發生顯色反應
科目:高中化學 來源: 題型:
【題目】實驗室制備純堿的主要步驟如流程所示:

四種鹽在不同溫度下的溶解度(g/100gH2O)表
溫度 物質 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - | - | - | - |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
提示:溫度高于35℃時NH4HCO3會分解,請回答:
(1)下列操作或描述正確的是________。
A.溫度控制在30-35℃是因為溫度太高NH4HCO3會分解,溫度太低反應速率太慢
B.保溫30min的目的是使反應充分進行
C.過濾后的濾液只有NH4Cl和NH4HCO3溶質
D.洗去晶體表面的雜質可以選用蒸餾水
(2)反應溫度控制在30~35℃,為控制此溫度范圍,采取的加熱方法為______________。
(3)常溫時,過濾后主要得到NaHCO3晶體的原因是______________。
(4)灼燒NaHCO3晶體的裝置為________。
A.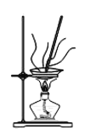 B.
B.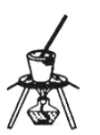 C.
C.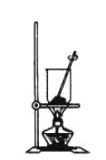
(5)洗滌NaHCO3晶體的操作______________。
(6)測定純堿產品中NaHCO3含量的方法:準確稱取純堿樣品Wg放入錐形瓶中加蒸餾水溶解,加1~2滴酚酞指示劑,用物質的量濃度為c(mol·L-1)的HCl溶液滴定至溶液由紅色到無色(指示CO32-+H+=HCO3-反應的終點)所用HCl溶液體積為V1mL。再加1~2滴甲基橙指示劑,繼續用HCl溶液滴定至溶液由黃變橙,所用HCl溶液體積為V2mL,寫出純堿樣品中NaHCO3質量分數的計算式:______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知CuO高溫灼燒生成Cu2O,Cu2O與稀H2SO4反應的離子方程式為:Cu2O+2H+═Cu+Cu2++H2O。現將經高溫灼燒后的CuO樣品投入足量稀硫酸中得到混合溶液,有關說法正確的是( )
A.反應中Cu2O只作氧化劑
B.若有28.8g Cu2O參加反應,則轉移電子數為0.2NA
C.Cu2O的穩定性比CuO弱
D.如果溶液中出現藍色,說明CuO已分解
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,有A、B、C、D四種無色溶液,它們分別是溶CH3COONa液、NH4Cl溶液,鹽酸和NaNO3溶液中的一種。已知A、B的水溶液中水的電離程度相同,A、C溶液的pH值相同。
則:(1)①B是___溶液,C是___。
②常溫下若B溶液中c(OH-)與C溶液中的c(H+)相同,B溶液的pH用pHb表示,C溶液的pH用pHc表示,則pHb+pHc=___![]() 填某個數
填某個數![]() 。
。
(2)已知某溶液中只存在OH-、H+、NH4+、Cl-四種離子,某同學推測其離子濃度大小順序有以下幾種:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
則:(Ⅰ)上述關系一定不正確的是___![]() 填序號
填序號![]() 。
。
(Ⅱ)若溶液中只有一種溶質,則該溶液中離子濃度的大小關系為___(填序號)。
(Ⅲ)若四種離子濃度關系有c(NH4+)=c(Cl-),則該溶液顯___(填“酸性”、“堿性”或“中性”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法錯誤的是( )
A.![]() H、
H、![]() H、H+和H2是氫元素的四種不同粒子
H、H+和H2是氫元素的四種不同粒子
B.![]() Ca和
Ca和![]() Ca是兩種不同的元素
Ca是兩種不同的元素
C.![]() H和
H和![]() H是不同的核素
H是不同的核素
D.![]() C、
C、![]() C、
C、![]() C互為同位素,物理性質不同,但化學性質幾乎完全相同
C互為同位素,物理性質不同,但化學性質幾乎完全相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NH3是重要的化工原料,經一系列反應可得到HNO3、CO(NH2)2、HCN等產品。
(1)以氨氣為原料合成HNO3工藝如下,寫出N2O4轉化為HNO3的反應方程式_____。
![]()
(2)以NH3和CO2為原料生產尿素的反應如下:
反應Ⅰ:2NH3(l) + CO2(g) ![]() NH2COONH4(l) Δ H1 = a kJ·mol-1
NH2COONH4(l) Δ H1 = a kJ·mol-1
反應Ⅱ:NH2COONH4(l) ![]() NH2CONH2(l) + H2O(l) Δ H2 = b kJ·mol-1
NH2CONH2(l) + H2O(l) Δ H2 = b kJ·mol-1
① 已知NH3(l) ![]() NH3(g) Δ H3 = c kJ·mol-1 反應2NH3(g) + CO2(g)
NH3(g) Δ H3 = c kJ·mol-1 反應2NH3(g) + CO2(g) ![]() NH2CONH2(l) + H2O(l) Δ H4=_____kJ·mol-1(用含a、b、c的式子表示),該反應能自發進行的主要原因是_____。
NH2CONH2(l) + H2O(l) Δ H4=_____kJ·mol-1(用含a、b、c的式子表示),該反應能自發進行的主要原因是_____。
② 一定條件下,往恒容密閉容器中投入4 mol NH3和 1 mol CO2,測得各組分物質的量隨時間變化如圖1。下列說法正確的是_____。
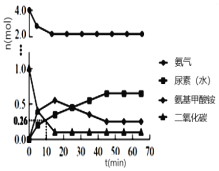
A.選擇合適的碳氮比有利于提高產率
B.反應Ⅰ的活化能比反應Ⅱ小
C.過量氨氣可以與反應生成的水結合,有利于尿素合成
D.氣體物質的量不再變化時,反應達到平衡狀態
(3)工業上利用氨氣生產氫氰酸的反應為CH4(g) + NH3(g) ![]() HCN(g) + 3H2(g) Δ H>0
HCN(g) + 3H2(g) Δ H>0
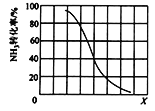
① 其他條件一定,達到平衡時NH3轉化率隨外界條件X變化的關系如圖所示。X代表的是_____(填“溫度”或“壓強”)。

② 其它條件一定時,向2 L密閉容器中加入n mol CH4和2 mol NH3,平衡時NH3體積分數隨n變化的關系如圖所示。平衡常數K=_____(請寫出計算過程)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,在體積固定的密閉容器中發生可逆反應3X(g)![]() 2Y(g)+Z(g),下列能說明達到化學平衡狀態的是
2Y(g)+Z(g),下列能說明達到化學平衡狀態的是
A.壓強不再發生變化B.ΔH的數值不再變化
C.反應物和生成物的濃度不再改變D.Y的生成速率是Z的生成速率的2倍
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室里也可以利用以下反應制取少量氯氣:2KMnO4+16HCl(濃)![]() 2KCl+2MnCl2+8H2O+5Cl2↑,關于該反應的說法正確的是( )
2KCl+2MnCl2+8H2O+5Cl2↑,關于該反應的說法正確的是( )
A.KMnO4中的錳元素被氧化
B.Cl2既是氧化產物,又是還原產物
C.HCl在反應中只做還原劑
D.每生成1molCl2轉移電子的物質的量為2mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是某溫度下,將足量的BaSO4固體溶于一定量水中達到溶解平衡后,假定溶液體積不變的情況下,加入Na2CO3使c(CO32-)增大過程中,溶液中c(Ba2+)和c(SO42-)的變化曲線。根據圖中的數據分析,下列說法正確的是:
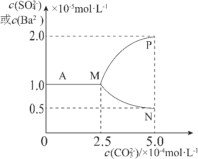
A.該溫度下BaSO4的Ksp=2.5×10-9mol2·L-2
B.圖中表示c(Ba2+)的曲線是MP
C.反應BaSO4(s)+CO32-(aq)![]() BaCO3(s)+SO42-(aq)的平衡常數K=0.04
BaCO3(s)+SO42-(aq)的平衡常數K=0.04
D.如用1LNa2CO3溶液將0.1molBaSO4固體完全轉化為BaCO3,則原Na2CO3溶液濃度至少為2.5mol·L-1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com