
若已知在相同溫度下物質的溶解度大小有:S[Zn(OH)2]>S(ZnS),S(MgCO3)>S[Mg(OH)2];而溶解或電離出S2-的能力,有FeS>H2S>CuS。則下列離子方程式錯誤的是
A.Mg2++2HCO3-+2Ca2++4OH-→Mg(OH)2↓+2CaCO3↓+2H2O
B.Cu2++H2S→CuS↓+2H+
C.FeS+2H+→Fe2++H2S↑
D.Zn2++S2-+2H2O→Zn(OH)2↓+H2S↑
科目:高中化學 來源: 題型:
| 容器編號 | 起始時各物質物質的量/mol | 達到平衡的時間/min | 達平衡時體系能量的變化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出熱量:32.8 kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出熱量:Q | |
| 4 |
| Vt1 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| 容器編號 | 起始時各物質物質的量/mol | 達到平衡的時間/min | 達平衡時體系能量的變化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出熱量:32.8 kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出熱量:Q | |
| 4 |
| Vt1 |
查看答案和解析>>
科目:高中化學 來源:2012-2013學年黑龍江省大慶市高三上學期期末考試化學試卷(解析版) 題型:填空題
(14分)工業上利用CO和水蒸氣在一定條件下發生反應制取氫氣:
CO(g)+H2O(g)  CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
某小組研究在相同溫度下該反應過程中的能量變化。他們分別在體積均為V L的兩個恒溫恒容密閉容器中加入一定量的反應物,使其在相同溫度下發生反應。相關數據如下:
|
容器編號 |
起始時各物質物質的量/mol |
達到平衡的時間/min |
達平衡時體系能量的變化/kJ |
||||
|
CO |
H2O |
CO2 |
H2 |
||||
|
① |
1 |
4 |
0 |
0 |
t1 |
放出熱量:32.8 kJ |
|
|
② |
2 |
8 |
0 |
0 |
t2 |
放出熱量:Q |
|
(1)該反應過程中,反應物分子化學鍵斷裂時所吸收的總能量 (填“大于”、“小于”或“等于”)生成物分子化學鍵形成時所釋放的總能量。
(2)容器①中反應達平衡時,CO的轉化率為 %。
(3)計算容器②中反應的平衡常數K= 。
(4)下列敘述正確的是 (填字母序號)。
a.平衡時,兩容器中H2的體積分數相等
b.容器②中反應達平衡狀態時,Q > 65.6 kJ
c.反應開始時,兩容器中反應的化學反應速率相等
d.容器①中,反應的化學反應速率為:
(5)已知:2H2 (g) + O2 (g) ="=" 2H2O (g) ΔH=-484 kJ/mol,寫出CO完全燃燒生成CO2的熱化學方程式: 。
(6)容器①中反應進行到t min時,測得混合氣體中CO2的物質的量為0.6 mol。若用
200 mL 5 mol/L的NaOH溶液將其完全吸收,反應的離子方程式為(用一個離子方程式表示) 。
查看答案和解析>>
科目:高中化學 來源:2014屆吉林省高二上學期期末考試化學試卷(解析版) 題型:填空題
(10分)工業上利用CO和水蒸氣在一定條件下發生反應制取氫氣:
CO(g)+H2O(g)  CO2(g)+H2(g)
△H=-41 kJ/mol
CO2(g)+H2(g)
△H=-41 kJ/mol
某小組研究在相同溫度下該反應過程中的能量變化。他們分別在體積均為V L的兩個恒溫恒容密閉容器中加入一定量的反應物,使其在相同溫度下發生反應。相關數據如下:
|
容器編號 |
起始時各物質物質的量/mol |
達到平衡的時間/min |
達平衡時體系能量的變化/kJ |
||||
|
CO |
H2O |
CO2 |
H2 |
||||
|
① |
1 |
4 |
0 |
0 |
t1 |
放出熱量:32.8 kJ |
|
|
② |
2 |
8 |
0 |
0 |
t2 |
放出熱量:Q |
|
(1)該反應過程中,反應物分子化學鍵斷裂時所吸收的總能量 (填“大于”、“小于”或“等于”)生成物分子化學鍵形成時所釋放的總能量。
(2)容器①中反應達平衡時,CO的轉化率為 %。
(3)下列敘述正確的是 (填字母序號)。
A、平衡時,兩容器中H2的體積分數相等
B、容器②中反應達平衡狀態時,Q > 65.6 kJ
C、反應開始時,兩容器中反應的化學反應速率相等
D、容器①中,化學反應速率為:
(4)已知:2H2 (g) + O2 (g) = 2H2O (g) ΔH=-484 kJ/mol,寫出CO完全燃燒生成CO2的熱化學方程式: 。
(5)容器①中反應進行到t min時,測得混合氣體中CO2的物質的量為0.6 mol。若用200 ml 、5 mol/L的NaOH溶液將其完全吸收,反應的離子方程式為(用一個離子方程式表示) 。
查看答案和解析>>
科目:高中化學 來源:2013屆河北省五校聯盟高三上學期調研考試理科綜合化學試卷(解析版) 題型:實驗題
(14分)工業上利用CO和水蒸氣在一定條件下發生反應制取氫氣:
CO(g)+H2O(g)  CO2(g)+H2(g)
△H=-41 kJ/mol
CO2(g)+H2(g)
△H=-41 kJ/mol
某小組研究在相同溫度下該反應過程中的能量變化。他們分別在體積均為V L的兩個恒溫恒容密閉容器中加入一定量的反應物,使其在相同溫度下發生反應。相關數據如下:
|
容器編號 |
起始時各物質物質的量/mol |
達到平衡的時間/min |
達平衡時體系能量的變化/kJ |
||||
|
CO |
H2O |
CO2 |
H2 |
||||
|
① |
1 |
4 |
0 |
0 |
t1 |
放出熱量:32.8 kJ |
|
|
② |
2 |
8 |
0 |
0 |
t2 |
放出熱量:Q |
|
(1)該反應過程中,反應物分子化學鍵斷裂時所吸收的總能量 (填“大于”、
“小于”或“等于”)生成物分子化學鍵形成時所釋放的總能量。
(2)容器①中反應達平衡時,CO的轉化率為 %。
(3)計算容器②中反應的平衡常數K= 。
(4)下列敘述正確的是 (填字母序號)。
a.平衡時,兩容器中H2的體積分數相等
b.容器②中反應達平衡狀態時,Q > 65.6 kJ
c.反應開始時,兩容器中反應的化學反應速率相等
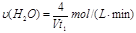 d.容器①中,化學反應速率為:
d.容器①中,化學反應速率為:
(5)已知:2H2 (g) + O2 (g) = 2H2O (g) ΔH=-484 kJ/mol,寫出CO完全燃燒生成CO2的熱化學方程式: 。
(6)容器①中反應進行到t min時,測得混合氣體中CO2的物質的量為0.6 mol。若用200 mL 5 mol/L的NaOH溶液將其完全吸收,反應的離子方程式為(用一個離子方程式表示) 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com