
【題目】高氯酸銨(NH4ClO4)可用作火箭推進劑等。制備NH4ClO4的工藝流程如下:
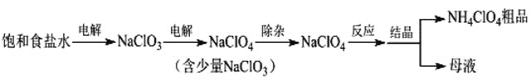
(1)電解NaClO3溶液時,ClO3-在____極發生反應,其電極反應式為____。
(2)“除雜”有兩種方案。
①方案1:加入鹽酸和H2O2溶液,NaClO3轉化為ClO2,化學方程式為______。
方案2:加入氨水和FeCl24H2O,NaClO3轉化為Cl-,離子方程式為____,如果FeCl24H2O過量會出現黑色磁性沉淀,該沉淀可能是______。(填化學式)
②比較氧化性:ClO3-_____ClO4-(填“>”或“<”)。
③兩種方案相比,方案1的優點是____。(答一條即可)
(3)“反應”時用NaClO4和NH4Cl在90℃制備NH4ClO4。如果用濃鹽酸和液氨代替NH4Cl,則無需加熱,原因是____。
(4)該流程中可循環利用的物質是_________。(填化學式)
【答案】陽 ClO3-+H2O-2e- =ClO4-+2H+ 2NaClO3+2HCl+H2O2=2ClO2↑+2NaCl+2H2O+O2↑ 6Fe2++ClO3-+3H2O+12NH3H2O=6Fe(OH)3↓+Cl-+12NH4+ Fe3O4 ![]() 操作步驟簡單(或過量的H2O2易除去等合理答案) 濃鹽酸和液氨的反應為放熱反應 NaCl
操作步驟簡單(或過量的H2O2易除去等合理答案) 濃鹽酸和液氨的反應為放熱反應 NaCl
【解析】
(1)氯酸根離子化合價為+5價升高到高氯酸根離子的+7價,發生氧化反應,為陽極反應;
(2)①雙氧水把氯酸鈉還原為二氧化氯;氨水、亞鐵離子、氯酸根離子反應生成氯離子、氫氧化鐵沉淀、銨根離子;如果FeCl24H2O過量會出現黑色磁性沉淀四氧化三鐵;
②根據以上分析,氯酸根離子氧化性大于高氯酸根離子;
③方案1的優點是操作步驟簡單;
(3)濃鹽酸和液氨為放熱反應;
(4)根據流程判斷。
(1)氯酸根離子化合價為+5價升高到高氯酸根離子的+7價,發生氧化反應,在陽極發生反應,反應式為:ClO3-+H2O-2e- =ClO4-+2H+;
(2)①雙氧水把氯酸鈉還原為二氧化氯,方程式為:2NaClO3+2HCl+H2O2=2ClO2↑+2NaCl +2H2O+O2↑;氨水、亞鐵離子、氯酸根離子反應生成氯離子、氫氧化鐵沉淀、銨根離子,離子方程式為:6Fe2++ClO3-+3H2O+12NH3H2O=6Fe(OH)3↓+Cl-+12NH4+;如果FeCl24H2O過量會出現黑色磁性沉淀,該沉淀可能是四氧化三鐵;
②根據以上分析,氯酸根離子氧化性大于高氯酸根離子;
③兩種方案相比,方案1的優點是操作步驟簡單(或過量的H2O2易除去等合理答案);
(3)由于濃鹽酸和液氨的反應為放熱反應,故反應無需加熱;
(4)根據流程可知,該流程中可循環利用的物質是氯化鈉。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】氧化還原反應在生產生活中有著重要的應用。請按要求寫出相應的方程式。
(1)ClO2是一種高效安全的殺菌消毒劑。氯化鈉電解法生產ClO2工藝原理示意圖如下:
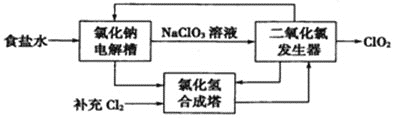
①寫出氯化鈉電解槽內發生反應的離子方程式:________________________。
②寫出ClO2發生器中的化學方程式,并標出電子轉移的方向及數目:_____________。
(2)甲醇燃料電池是采用鉑作電極催化劑,其工作原理的示意圖如下:
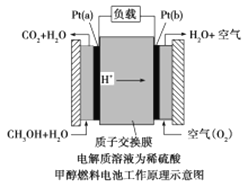
請回答下列問題:
Pt(a)電極是電池的_______極,電極反應式為______________________;
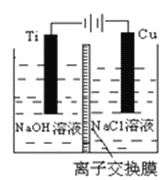
(3)方法Ⅱ采用離子交換膜控制電解液中OH-的濃度而制備納米Cu2O,裝置如圖所示,該電池的陽極反應式為______________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
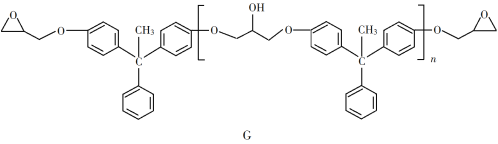
【題目】環氧樹脂因其具有良好的機械性能、絕緣性能以及與各種材料的粘結性能,已廣泛應用于涂料和膠黏劑等領域。下面是制備一種新型環氧樹脂G的合成路線:
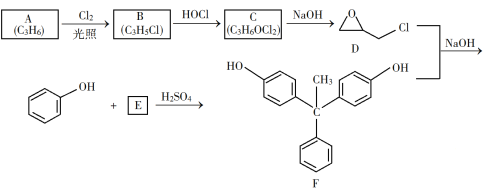
已知以下信息:
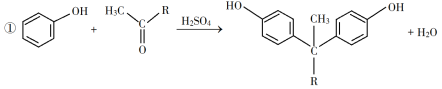
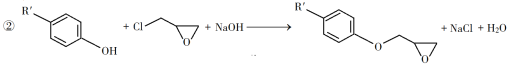
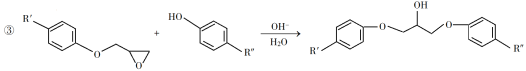
(1)A是一種烯烴,化學名稱為__________。
(2)由B生成C的反應類型為__________。
(3)由C生成D的反應方程式為__________。
(4)E的結構簡式為__________。
(5)E的二氯代物有多種同分異構體,請寫出其中能同時滿足以下條件的芳香化合物的結構簡式_____、_______。
①能發生銀鏡反應;②核磁共振氫譜有三組峰,且峰面積比為3∶2∶1。
(6)假設化合物D、F和NaOH恰好完全反應生成1 mol單一聚合度的G,若生成的NaCl和H2O的總質量為765 g,則G的n值理論上應等于__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗裝置(夾持和尾氣處理裝置已省略)進行的相應實驗,能達到實驗目的的是( )
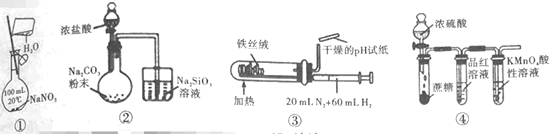
A.利用①裝置,配制一定物質的量濃度的NaNO3溶液
B.利用②裝置,驗證元素的非金屬性:Cl>C>Si
C.利用③裝置,合成氨并檢驗氨的生成
D.利用④裝置,驗證濃H2SO4具有脫水性、強氧化性,SO2具有漂白性、還原性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】課堂學習中,同學們利用鋁條、鋅片、銅片、導線、電流計、橘子汁等物質來探究原電池的組成,下列結論不正確的是
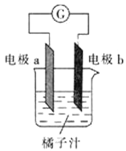
A.若a為鋁片,b為鋅片或銅片,則導線中一定產生電流
B.若a為鋅片,b為鋁片,則b極上的電極反應式為![]()
C.原電池是將化學能轉化為電能的裝置
D.若a、b均為鋁片,則電流計指針不偏轉
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A.某 C3H6 分子中只有一種氫,說明該有機物為丙烯
B.乙烯能使溴水褪色,說明乙烯具有漂白性
C.苯能與氫氣發生加成反應,說明苯分子中含有碳碳雙鍵
D.甲苯易形成 2,4,6-三硝基甲苯而苯不能形成 1,3,5-三硝基苯,說明甲基對苯環有影響
查看答案和解析>>
科目:高中化學 來源: 題型:
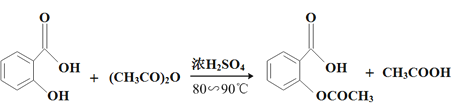
【題目】阿司匹林(乙酰水楊酸, )是世界上應用最廣泛的解熱、鎮痛和抗炎藥。乙酰水楊酸受熱易分解,分解溫度為128℃~135℃。某學習小組在實驗室以水楊酸(鄰羥基苯甲酸)與醋酸酐[(CH3CO)2O]為主要原料合成阿司匹林,反應原理如下:
)是世界上應用最廣泛的解熱、鎮痛和抗炎藥。乙酰水楊酸受熱易分解,分解溫度為128℃~135℃。某學習小組在實驗室以水楊酸(鄰羥基苯甲酸)與醋酸酐[(CH3CO)2O]為主要原料合成阿司匹林,反應原理如下:
制備基本操作流程如下:

主要試劑和產品的物理常數如下表所示:
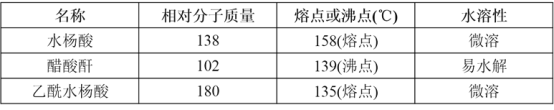
請根據以上信息回答下列問題:
(1)制備阿司匹林時,要使用干燥的儀器的原因是___。
(2)合成阿司匹林時,最合適的加熱方法是___。
(3)提純粗產品流程如下,加熱回流裝置如圖:


①使用溫度計的目的是控制加熱的溫度,防止___。
②冷凝水的流進方向是___(填“a”或“b”)。
③趁熱過濾的原因是___。
④下列說法不正確的是___(填字母)。
A.此種提純方法中乙酸乙酯的作用是做溶劑
B.此種提純粗產品的方法叫重結晶
C.根據以上提純過程可以得出阿司匹林在乙酸乙酯中的溶解度低溫時大
D.可以用紫色石蕊溶液判斷產品中是否含有未反應完的水楊酸
(4)在實驗中原料用量:2.0g水楊酸、5.0mL醋酸酐(ρ=1.08g/cm3),最終稱得產品質量為2.2g,則所得乙酰水楊酸的產率為___%。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定溫度下,將2molA和2molB兩種氣體相混合于容積為2L的某密閉容器中,發生如下反應:3A(g)+B(g)![]() xC(g)+2D(g),2min末反應達到平衡狀態,此時測得D、C的濃度均為0.4mol/L,請填寫下列空白:
xC(g)+2D(g),2min末反應達到平衡狀態,此時測得D、C的濃度均為0.4mol/L,請填寫下列空白:
(1)x值等于_____________。
(2)A的轉化率為_______________。
(3)生成D的反應速率為_____________。
(4)如果增大反應體系的壓強,則平衡體系中C的質量分數 _________(增大、減小或不變)。
(5)在此溫度下,該化學反應的平衡常數k=__________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E都為短周期元素,A是相對原子質量最小的元素;B的+1價陽離子和C的﹣1價陰離子都與氖原子具有相同的電子層結構;D在C的下一周期,可與B形成BD型離子化合物;E和C為同一周期元素,其最高價氧化物對應的水化物為一種強酸。請根據以上信息回答下列問題:
(1)B元素在元素周期表中的位置是第______周期______族;
(2)畫出C元素的原子結構示意圖______;
(3)與E的氫化物分子所含電子總數相等的分子是______(舉一例,填化學式,下同)、陽離子是______;
(4)A與D形成的化合物中含有化學鍵的類型是_____。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com