
有下列兩種轉化途徑,某些反應條件和產物已省略。下列有關說法不正確的是
途徑① S H2SO4
H2SO4
途徑② S SO2
SO2 SO3
SO3 H2SO4
H2SO4
A.途徑①反應中體現了濃硝酸的強氧化性和酸性
B.途徑②的第二步反應在實際生產中可以通過增大O2濃度來降低成本
C.由途徑①和②分別制取1 mol H2SO4,理論上各消耗1 mol S,各轉移6 mol e-
D.途徑②與途徑①相比更能體現“綠色化學”的理念是因為途徑②比途徑①污染相對小且原子利用率高
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源:2015-2016學年廣東省高一下期中化學試卷(解析版) 題型:選擇題
短周期金屬元素甲~戊在元素周期表中的相對位置如右表所示,下面判斷正確的是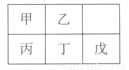
A.原子半徑: 丙<丁<戊 B.金屬性:甲>丙
C.氫氧化物堿性:丙>丁>戊 D.最外層電子數:甲>乙
查看答案和解析>>
科目:高中化學 來源:2015-2016學年廣西河池高中高一下第二次月考化學試卷(解析版) 題型:計算題
將等物質的量的H2和I2(g)加入密閉容器中進行反應:H2+I2(g)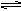 2HI,反應進行到2min時測得反應速率υ(HI)=0.1mol/(L·min),I2(g)的物質的量濃度為0.4mol/L。
2HI,反應進行到2min時測得反應速率υ(HI)=0.1mol/(L·min),I2(g)的物質的量濃度為0.4mol/L。
(1)反應速率υ(I2)= 。
(2)2min未c(HI)= mol/L。
(3)起始時,c(H2)= mol/L,反應進行到2min時,容器中I2所占的體積分數是_______________。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年云南省高一下期中化學試卷(解析版) 題型:填空題
短周期元素A、B、C、D、E的原子序數依次增大,其元素特征信息如表:
元素編號 | 元素特征信息 |
A | 最高正價和最低負價的絕對值之差為2 |
B | 和E同主族 |
C | lmo1C單質能與冷水反應,在標準狀況下生成11.2LH2 |
D | 原子最外層電子數等于其周期序數 |
E | 負一價陰離子的電子層結構與Ar原子相同 |
(1) A在周期表中的位置為 。
(2)B和C形成的化合物的電子式為 。
(3)B和D簡單離子的半徑大小為 。
(4)元素非金屬性強弱比較有很多方法,其中B和E的非金屬性強弱的研究方案中不可行的是 (填序號)。
A.比較兩種單質的顏色
B.比較兩種單質與H2化合的難易程度
C.依據兩元素在周期表中的位置
D.比較對應陰離子的還原性
e.比較最高價氧化物對應水化物的酸性
(5)E元素能與另外四種元素中的一種元素形成共價化合物,分子中的原子個數比為1∶3,相對分子質量為120.5,則該物質的化學式為 。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年云南省高一下期中化學試卷(解析版) 題型:選擇題
下列反應既屬于氧化還原反應,又是吸熱反應的是
A.鋅粒與稀硫酸的反應 B.灼熱的木炭與CO2的反應
C.乙醇在氧氣中燃燒 D.Ba(OH)2·8H2O晶體與NH4Cl晶體反應
查看答案和解析>>
科目:高中化學 來源:2015-2016學年云南省高一下期中化學試卷(解析版) 題型:選擇題
微型鋰碘電池可用做植入某些心臟病人體內的心臟起搏器所用的電源。這種電池中的電解質是固體電解質LiI,其中的導電離子是I-。下列有關說法正確的是
A.正極反應:2Li-2e-=2Li+
B.負極反應:I2+2e-=2I-
C.總反應是:2Li+I2=2LiI
D.金屬鋰作正極
查看答案和解析>>
科目:高中化學 來源:2015-2016學年云南省高一下期中化學試卷(解析版) 題型:選擇題
下列有關硅元素的敘述中,正確的是
A.SiO2不溶于水,也不溶于任何酸 B.SiO2是良好的半導體材料
C.硅是地殼中含量最多的元素 D.水玻璃可用作木材防火劑
查看答案和解析>>
科目:高中化學 來源:2015-2016學年江西省高二下期中化學試卷(解析版) 題型:選擇題
除去被提純物質中的雜質,方案正確的是
編號 | 被提純的物質 | 雜質 | 除雜試劑 | 除雜方法 |
A | 乙烷 | 乙烯 | 酸性KMnO4溶液 | 洗氣 |
B | 乙酸乙酯 | 乙酸 | 飽和Na2CO3溶液 | 分液 |
C | 乙酸 | 乙醛 | 新制Cu(OH)2 | 過濾 |
D | 苯 | 苯酚 | 濃溴水 | 過濾 |
查看答案和解析>>
科目:高中化學 來源:2016屆吉林省高三第五次模擬理綜化學試卷(解析版) 題型:選擇題
原子結構決定元素的性質,下列說法中正確的是
A.Na、Al、Cl的原子半徑依次減小,Na+、Al3+、Cl-的離子半徑也依次減小,
B.在第ⅥA族元素的氫化物(H2R)中,熱穩定性最強的其沸點也一定最高
C.第二周期元素的最高正化合價都等于其原子的最外層電子數
D.非金屬元素的非金屬性越強,其氧化物對應水化物的酸性也一定越強
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com