
已知可逆反應CO(g)+H2O(g) CO2(g)+H2(g),達到平衡時,K=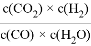 ,K是常數,只與溫度有關,與濃度無關。
,K是常數,只與溫度有關,與濃度無關。
(1)830K時,若起始時c(CO)=2 mol·L-1,c(H2O)=3 mol·L-1,平衡時CO的轉化率為60%,水蒸氣的轉化率為____________;K值為_____________。
(2)830 K時,若只將起始時c(H2O)改為6 mol·L-1,則水蒸氣的轉化率為_______ 。
(3)若830 K時,起始濃度c(CO)=a mol·L-1, c(H2O)=b mol·L-1,H2的平衡濃度c(H2)=c mol·L-1
①a、b、c之間的關系式是_____________;②當a=b時,a=___________c。
科目:高中化學 來源:2017屆陜西省高三上學期第二次模考化學試卷(解析版) 題型:選擇題
化學中常用圖像直觀地描述化學反應的進程或結果。下列圖像描述正確的是
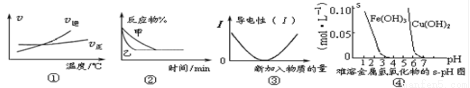
A. 根據圖①可判斷可逆反應“A2(g)+3B2(g) 2AB3(g)”的 ΔH>0
2AB3(g)”的 ΔH>0
B. 圖②表示壓強對可逆反應 2A(g)+2B(g) 3C(g)+D(s)的影響,乙的壓強大
3C(g)+D(s)的影響,乙的壓強大
C. 圖③可表示乙酸溶液中通入氨氣至過量過程中溶液導電性的變化
D. 根據圖④,除去CuSO4溶液中的Fe3+可采用向溶液中加入適量CuO至pH在4左右
查看答案和解析>>
科目:高中化學 來源:2017屆浙江省高三3月選考化學試卷(解析版) 題型:選擇題
下列表示正確的是
A. 氯化鈉的分子式:NaCl B. 乙醇的結構式:C2H5OH
C. 水分子的比例模型: D. Mg2+結構示意圖:
D. Mg2+結構示意圖:
查看答案和解析>>
科目:高中化學 來源:2016-2017學年黑龍江省高一下學期開學考試化學試卷(解析版) 題型:選擇題
下列說法不正確的是( )
A. 綠色食品是不含任何化學物質的食品
B. 灼燒某物質時,用肉眼直接觀察到火焰呈黃色,則可判斷該物質一定含鈉元素
C. 將鎂條放在空氣中充分燃燒,可以得到三種固體
D. 稱取等質量的兩份鋁粉,分別加入過量的稀HCl和過量的NaOH溶液,則放出氫氣的體積相等(同溫同壓下)
查看答案和解析>>
科目:高中化學 來源:2016-2017學年黑龍江省高一下學期開學考試化學試卷(解析版) 題型:選擇題
下列離子方程式書寫正確的是( )
A. 在FeCl3溶液中投入足量的Zn粉:2Fe3++ Zn==Zn2++ 2Fe2+
B. 磁性氧化鐵(Fe3O4)溶于氫碘酸:Fe3O4 + 8H+=Fe2+ + 2Fe3++4H2O
C. NaHSO4溶液與Ba(OH)2溶液混合后呈中性: H++ SO42-+Ba2++ OH- =BaSO4↓+H2O
D. 過量的氯氣通入溴化亞鐵溶液中:3Cl2+2Fe2++4Br-=6Cl-+2Fe3++2Br2
查看答案和解析>>
科目:高中化學 來源:2016-2017學年新疆哈密地區第二中學高二上學期期末考試化學試卷(解析版) 題型:選擇題
常溫下0.1 mol·L-1某一元酸(HA)溶液中 =1×10-8,下列敘述正確的是( )
=1×10-8,下列敘述正確的是( )
A. 該溶液中由水電離出的c(H+)=1×10-11 mol·L-1
B. 濃度均為0.1mol/L的HA和NaA溶液等體積混合后,若溶液呈酸性,則c(A—)>c(HA)>c(Na+)>c(H+)>c(OH—)
C. 0.1 mol·L-1HA溶液與0.05 mol·L-1 NaOH溶液等體積混合后所得溶液中2c(H+)+ c(HA) = c(A—) + 2c(OH—)
D. 0.1 mol·L-1HA溶液與0.05 mol·L-1 NaOH溶液等體積混合后所得溶液中c(A—) + c(HA) = c(Na+)
查看答案和解析>>
科目:高中化學 來源:2016-2017學年新疆哈密地區第二中學高二上學期期末考試化學試卷(解析版) 題型:選擇題
下列圖示與對應的敘述相符的是
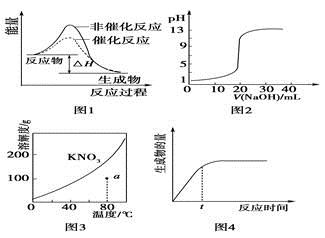
A. 圖1表示某吸熱反應分別在有、無催化劑的情況下反應過程中的能量變化
B. 圖2表示0.1000 mol·L-1NaOH溶液滴定20.00 mL 0.1000 mol·L-1CH3COOH溶液所得到的滴定曲線
C. 圖3表示KNO3的溶解度曲線,圖中a點所示的溶液是80℃時KNO3的不飽和溶液
D. 圖4表示某可逆反應生成物的量隨反應時間變化的曲線,由圖知t時反應物轉化率最大
查看答案和解析>>
科目:高中化學 來源:遼寧省大連市2017屆高三3月雙基測試化學試卷 題型:推斷題
【化學——有機化學基礎】
香豆素(結構如下圖中I所示)是用途廣泛的香料,由香豆素經下列圖示的步驟可轉變為水楊酸。
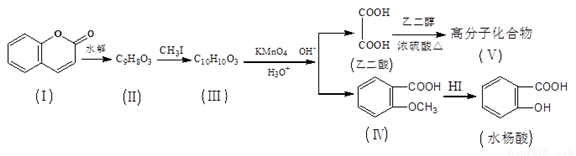
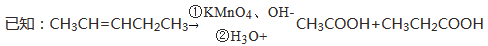
請回答下列問題:
(1)香豆素分子中的官能團的名稱為__________,步驟II→III的反應類型為___________。
(2)有機物III的結構簡式為_________,在上述轉化過程中,設計反應步驟II→III的目的是_____。
(3)下列關于有機物I、II、III、IV的敘述中正確的是________(選填序號)。
A. 可用FeCl3溶液來鑒別II和III
B. IV中核磁共振氫譜共有4種峰
C. I、II、III均可使溴的四氯化碳溶液褪色
D. 1molI最多能和5molH2發生加成反應
(4)寫出水楊酸與過量NaHCO3溶液反應的化學方程式_____________。
(5)化合物IV有多種同分異構體,符合下列兩個條件的芳香族同分異構體共有_____種。
①遇氯化鐵溶液發生顯色反應 ②能發生水解反應和銀鏡反應
其中,核磁共振氫譜共有5種吸收峰,且吸收峰面積比為1:2:2:2:1同分異構體的結構簡式為_____。
查看答案和解析>>
科目:高中化學 來源:2017屆貴州省貴陽市高三2月適應性考試(一)理綜化學試卷(解析版) 題型:實驗題
硫酸亞鐵銨[(NH4)2SO4·FeSO4·6H2O]俗稱莫爾鹽,是淺綠色晶體,可溶于水,在100℃~110℃時分解,常用作定量分析中的標準試劑。某化學小組以廢鐵屑為原料在實驗室中進行實驗探究——制備硫酸亞鐵銨并檢驗其純度,過程如下:
I.制備硫酸亞鐵銨
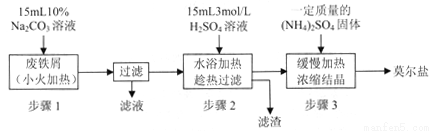
請回答下列問題:
(1)步驟l的作用是_________。(用離子方程式及必要的文字說明);
(2)步驟2中所加硫酸需過量,且不宜等到鐵屑完全反應后才過濾,其中蘊含的道理是_______________;
II.測定硫酸亞鐵銨的純度
稱取mg實驗室制備的硫酸亞鐵銨樣品,配成500ml溶液,取25. 00mL硫酸亞鐵按溶液,用0 . 1mol/L的酸性KMnO4溶液進行滴定,再重復滴定兩次。
(3)配制(NH4)2SO4·FeSO4溶液所用的蒸餾水,通常需加熱煮沸一段時間后,冷卻至室溫再使用,這樣操作的好處是___________________;
(4)滴定時發生反應的離子方程式為___________________;
(5)滴定終點時的現象為 ___________________;
(6)三次滴定測得酸性KMnO4溶液的用量平均值為VmL,則硫酸亞鐵銨樣品的純度為__________;
(7)化學小組分析發現這種檢測純度的方法不夠準確,目前處理氮氧化物污染的方法有多種,請你幫助他們設計一種檢測方案________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com