
【題目】下表為元素周期表的一部分。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
一 | ① | ||||||
二 | ② | ③ | ④ | ⑤ | ⑥ | ||
三 | ⑦ | ⑧ | ⑨ | ⑩ | |||
四 | |||||||
(1)表中元素__
(2)表中元素⑦的原子結構示意圖為__,在周期表中的位置為____
(3)表中元素⑥⑩的氫化物的穩定性順序為__(填寫化學式,下同)。
(4)表中元素⑩的最高價氧化物對應水化物的酸性:__。
(5)表中元素②和⑦的最高價氧化物對應水化物的堿性:__。
【答案】F K Br 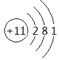 第三周期IA族 HF>HCl HClO4>HBrO4 NaOH>LiOH
第三周期IA族 HF>HCl HClO4>HBrO4 NaOH>LiOH
【解析】
根據題給圖表,可判斷:①為H,②為Li,③為C,④為N,⑤為O,⑥為F,⑦為Na,⑧為Mg,⑨為S,⑩為Cl,為K,為Al,為Br。可在此基礎上解各小題。
(1)元素周期表中右上角(零族除外)元素非金屬性最強,左下角金屬性最強。所以,表中F的非金屬性最強,K的金屬性最強;Br的單質Br2室溫下呈液態。
答案為:F;K;Br;
(2)表中元素⑦為Na,原子結構示意圖為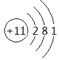 ,在周期表中的位置為第三周期IA族。
,在周期表中的位置為第三周期IA族。
答案為: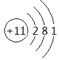 ;第三周期IA族;
;第三周期IA族;
(3)表中元素⑥、⑩分別為F、Cl,同主族元素,隨核電荷數的增大,非金屬性逐漸減弱,氫化物穩定性逐漸下降。所以氫化物的穩定性順序為HF>HCl。
答案為:HF>HCl;
(4)表中元素⑩分別為Cl、Br,同主族元素,隨核電荷數的增大,非金屬性逐漸減弱,最高價氧化物對應水化物的酸性逐漸減弱。所以最高價氧化物對應水化物的酸性:HClO4>HBrO4。
答案為:HClO4>HBrO4;
(5)表中元素②和⑦分別為Li、Na,同主族元素,隨核電荷數的增大,金屬性逐漸增強,最高價氧化物對應水化物的堿性逐漸增強。所以最高價氧化物對應水化物的堿性:NaOH>LiOH。
答案為:NaOH>LiOH。


 津橋教育計算小狀元系列答案
津橋教育計算小狀元系列答案科目:高中化學 來源: 題型:
【題目】硝酸生產中,500℃時,NH3和O2可能發生如下反應:
① 4NH3 (g) + 5O2 (g) ![]() 4NO (g) + 6H2O (g);△H = -907.2kJ·mol-1 K=1.1×1026
4NO (g) + 6H2O (g);△H = -907.2kJ·mol-1 K=1.1×1026
② 4NH3 (g) + 4O2 (g) ![]() 2N2O (g) + 6H2O (g);△H= -1104.9kJ·mol-1 K=4.4×1028
2N2O (g) + 6H2O (g);△H= -1104.9kJ·mol-1 K=4.4×1028
③ 4NH3 (g) + 3O2 (g) ![]() 2N2 (g) + 6H2O (g);△H= -1269.2kJ·mol-1 K=7.1×1034
2N2 (g) + 6H2O (g);△H= -1269.2kJ·mol-1 K=7.1×1034
下列說法正確的是
A.增大壓強,則反應的②K不變,反應①和③的K減小
B.500℃時,2NH3 (g) + 2O2 (g) ![]() N2O (g) + 3H2O (g) K=2.2×1028
N2O (g) + 3H2O (g) K=2.2×1028
C.500℃時,N2 (g) + O2 (g)= 2NO (g) △H = +181 kJ·mol-1
D.500℃時,2 mol NH3 與2.5 mol O2混合發生反應①,可放出熱量453.6 kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】科學家提出如下光分解法制備氫氣:
①2Ce4+(aq)+H2O(l)===2Ce3+(aq)+![]() O2(g)+2H+(aq) ΔH1
O2(g)+2H+(aq) ΔH1
②Ce3+(aq)+H2O(l)===Ce4+(aq)+![]() H2(g)+OH-(aq) ΔH2
H2(g)+OH-(aq) ΔH2
③H2O(l)===H+(aq)+OH-(aq) ΔH3
④2H2O(l)===2H2(g)+O2(g) ΔH4
下列說法正確的是( )
A. Ce4+能夠增大水分解反應的活化能,提高反應速率
B. Ce3+是反應②和反應③的催化劑
C. 上述反應中,ΔH4=2ΔH1+4ΔH2-4ΔH3
D. 通常條件下,反應④中生成H2、O2的速率之比為1∶2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某酯A,其分子式C6H12O2,已知

又知B、C、D、E均為有機物,D不與Na2CO3溶液反應,E不能發生銀鏡反應,則A結構可能有( )
A. 5種 B. 4種 C. 3種 D. 2種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對SCN-的性質進行探究,設計了以下實驗
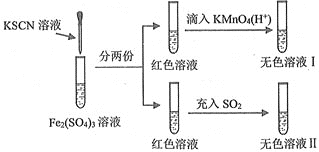
已知:(CN)2、(SCN)2、(OCN)2等稱之為擬鹵素,它們的化學性質均與鹵素單質相似。下列說法正確的是( )
A.溶液顏色變紅時發生反應的離子方程式是:Fe3++3SCN-=Fe(SCN)3↓
B.紅色溶液褪色表現了SO2的漂白性
C.氧化性:KMnO4>Fe3+>(SCN)2
D.無色溶液Ⅱ中滴入適量的KMnO4(H+)溶液,溶液又變成紅色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫氣既是一種優質的能源,又是一種重要化工原料,高純氫的制備是目前的研究熱點。
(1)甲烷水蒸氣催化重整是制備高純氫的方法之一,甲烷和水蒸氣反應的熱化學方程式是:
CH2(g)+2H2O(g)![]() CO2(g)+4H2(g) △H=+165.0kJ·mol-1
CO2(g)+4H2(g) △H=+165.0kJ·mol-1
已知反應器中存在如下反應過程:
I.CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206.4kJ·mol-1
CO(g)+3H2(g) △H1=+206.4kJ·mol-1
II.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2
CO2(g)+H2(g) △H2
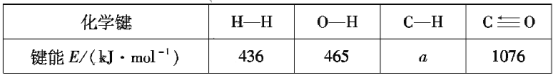
根據上述信息計算:a=___、△H2=___。
(2)某溫度下,4molH2O和lmolCH4在體積為2L的剛性容器內同時發生I、II反應,達平衡時,體系中n(CO)=bmol、n(CO2)=dmol,則該溫度下反應I的平衡常數K值為___(用字母表示)。
(3)欲增大CH4轉化為H2的平衡轉化率,可采取的措施有___(填標號)。
A.適當增大反應物投料比武n(H2O):n(CH4)
B.提高壓強
C.分離出CO2
(4)H2用于工業合成氨:N2+3H2![]() 2NH3。將n(N2):n(H2)=1:3的混合氣體,勻速通過裝有催化劑的反應器反應,反應器溫度變化與從反應器排出氣體中NH3的體積分數φ(NH3)關系如圖,反應器溫度升高NH3的體積分數φ(NH3)先增大后減小的原因是___。
2NH3。將n(N2):n(H2)=1:3的混合氣體,勻速通過裝有催化劑的反應器反應,反應器溫度變化與從反應器排出氣體中NH3的體積分數φ(NH3)關系如圖,反應器溫度升高NH3的體積分數φ(NH3)先增大后減小的原因是___。

某溫度下,n(N2):n(H2)=1:3的混合氣體在剛性容器內發生反應,起始氣體總壓為2×l07Pa,平衡時總壓為開始的90%,則H2的轉化率為___,氣體分壓(p分)=氣體總壓(p總)×體積分數,用某物質的平衡分壓代替物質的量濃度也可以表示化學平衡常數(記作Kp),此溫度下,該反應的化學平衡常數Kp=___(分壓列計算式、不化簡)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、W是原子序數依次增大的常見短周期元素,X的某種氫化物能使濕潤的紅色石蕊試紙變藍.Y的一種核素質量數為18,中子數為10.在同周期元素中Z的簡單離子半徑最小,W的單質是良好的半導體材料。下列說法中正確的是
A. 簡單氣態氫化物穩定性:W >X
B. Y元素的相對原子質量為18
C. X2H4的分子中極性鍵和非極性鍵數目比為4:l
D. 電解Z的熔融氯化物可以冶煉單質Z
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知充分燃燒a g乙炔氣體時生成1mol二氧化碳氣體和液態水,并放出熱量b kJ,則乙炔燃燒的熱化學方程式正確的是()
A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=+2b kJ/mol
B.C2H2(g)+![]() O2(g)=2CO2(g)+H2O(l);ΔH=-2b kJ/mol
O2(g)=2CO2(g)+H2O(l);ΔH=-2b kJ/mol
C.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-2b kJ/mol
D.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-b kJ/mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于下列各圖的敘述,正確的是
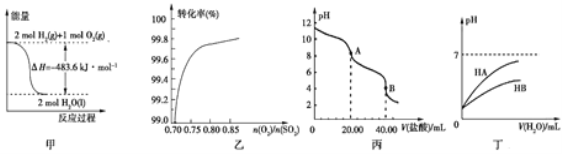
A. 圖甲表示H2與O2發生反應過程中的能量變化,則H2的燃燒熱為483.6 kJ·mol-1
B. 圖乙表示反應2SO2(g)+O2(g)![]() 2SO3(g)在其他條件不變時,O2的轉化率隨
2SO3(g)在其他條件不變時,O2的轉化率隨![]() 的變化關系
的變化關系
C. 圖丙表示用0.100 0 mol·L-1的鹽酸滴定20.00 mL 0.100 0 mol·L-1Na2CO3溶液的曲線,從A點到B點反應的離子方程式為:CO32-+2H+![]() CO2↑+H2O
CO2↑+H2O
D. 圖丁表示常溫下,稀釋HA、HB兩種酸的稀溶液時,溶液的pH隨加水量的變化,則同濃度溶液的pH:NaA<NaB
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com