
分析 (1)依據配制溶液體積選擇容量瓶規格,依據m=CVM計算溶質的質量;
(2)依據配制一定物質的量一般步驟選擇需要儀器;
(3)容量瓶帶有活塞,為防止漏水,使用前應檢查是否漏水;
(4)溶解過程需要用玻璃棒攪拌;移液過程需要用玻璃棒引流;
(5)分析操作對溶質的物質的量和溶液體積的影響,依據C=$\frac{n}{V}$進行誤差分析;
(6)凡是不當操作導致實驗失敗且無法補救的應重新配制,能夠補救的可以按照正確操作補救.
解答 解:(1)配制1mol•L-1的NaOH溶液450mL,應選擇500mL容量瓶,實際配制500mL容量瓶,需要溶質的質量m=1mol/L×0.5L×40g/mol=20.0g;
故答案為:20.0;
(2)配制溶液的操作步驟:首先計算出需要的溶質的質量,然后天平稱量,后放入燒杯中溶解,同時用玻璃棒攪拌,待溶液冷卻至室溫后,用玻璃杯引流移液至500ml容量瓶,然后洗滌燒杯和玻璃棒2至3次,將洗滌液也注入容量瓶,然后向容量瓶中注水,至液面離刻度線1至2CM時,改用膠頭滴管逐滴加入,至凹液面與刻度線相切,然后搖勻、裝瓶.在此過程中用到的儀器有:天平、量筒、燒杯、玻璃棒、500ml容量瓶、膠頭滴管,還缺少的儀器:500ml 容量瓶、膠頭滴管;
故答案為:500ml 容量瓶;膠頭滴管;
(3)容量瓶帶有活塞,為防止漏水,使用前應檢查是否漏水;
故答案為:查漏;
(4)溶解過程需要用玻璃棒攪拌;移液過程需要用玻璃棒引流;
故答案為:攪拌;引流;
(5)A.容量瓶實驗前用蒸餾水洗干凈,但未烘干,對溶質的物質的量和溶液的體積都不產生影響,溶液濃度不變,故A不選;
B.天平砝碼生銹,導致稱取的溶質的質量偏大,溶液濃度偏高,故B選;
C配制過程中遺漏了洗滌步驟,導致溶質的物質的量偏小,溶液濃度偏低,故C不選;
D未冷卻到室溫就注入容量瓶,冷卻后溶液體積偏小,溶液濃度偏高,故D選;
E加蒸餾水時不慎超過了刻度線,導致溶液體積偏大,溶液濃度偏低,故E不選;
F定容觀察液面時俯視,導致溶液體積偏小,溶液濃度偏高,故F選;
故選:BDF;
(6)未冷卻到室溫就注入容量瓶,冷卻后液面下降,實驗失敗,但是可以補救:用膠頭滴管逐滴滴加蒸餾水到凹液面最低處有刻度線相切;
故答案為:用膠頭滴管逐滴滴加蒸餾水到凹液面最低處有刻度線相切.
點評 本題考查了物質的量濃度的有關計算及配制一定物質的量濃度的溶液誤差分析,難度不大,明配制原理及操作步驟是解題關鍵,要注意配制一定物質的量濃度溶液的誤差分析,根據驗操作對c=$\frac{n}{V}$產生的影響判斷,分析變化的物理量,從而確定濃度的變化.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:解答題
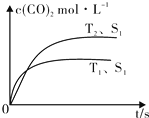 2013年霧霾天氣多次肆虐我國中東部地區.其中,汽車尾氣和燃煤尾氣是造成空氣污染的原因之一.
2013年霧霾天氣多次肆虐我國中東部地區.其中,汽車尾氣和燃煤尾氣是造成空氣污染的原因之一.| 溫度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
| 時間(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 壓強比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 500 mL溶液中的陰、陽離子總數為0.3NA | |
| B. | 500 mL溶液中NO3-離子濃度為0.2mol/L | |
| C. | 500 mL溶液中Ba2+離子濃度為0.2mol/L | |
| D. | 500 mL溶液中NO3-離子總數為0.2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com